题目内容
7.SO2虽是大气污染物之一,但也是重要的工业原料,某同学在实验室设计如下实验,对SO2的部分性质进行了探究.(1)二氧化硫的水溶液
①SO2易溶于水,常温常压下溶解度为1:40,其中有H2SO3生成.向SO2的饱和溶液中加入NaHSO3固体,有气体冒出,原因是SO2的水溶液中存在如下平衡SO2+H2O?H2SO3?H++HSO3-加入NaHSO3固体增加了c( HSO3-),平衡左移,降低了SO2的溶解度.(结合有关平衡方程式简要说明)
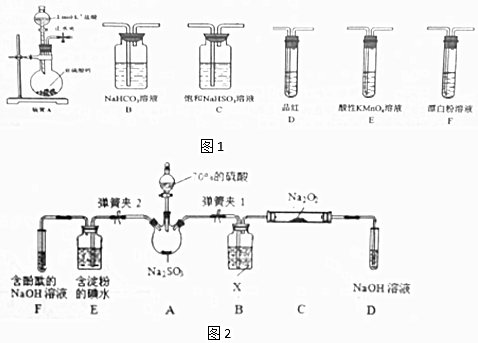
②欲验证酸性:H2SO3>HClO,选用图1的装置,其连接顺序为:A→C→B→E→D→F (按气流方向用大写字母表示即可).能证明H2SO3的酸性强于HClO的实验现象为D中品红不褪色,F中产生白色沉淀.
(2)二氧化硫的还原性
已知SO2具有还原性,可以还原I2,可以与Na2O2发生反应,按图2示装置进行实验.(部分固定装置未画出)
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
分析 (1)①SO2易溶于水,二氧化硫溶于水与水反应生成亚硫酸,亚硫酸为二元弱酸,存在电离平衡,加入NaHSO3固体,增加了c( HSO3-),平衡移动;
②要证明H2SO3的酸性强于HClO,因为二氧化硫与次氯酸根离子发生氧化还原反应,不能直接通入漂白粉溶液中,应先用二氧化硫制备二氧化碳,再通入漂白粉中,证明酸性H2SO3>H2CO3>HClO,制备的二氧化碳中有二氧化硫,故通入漂白粉之前除去二氧化硫气体,D中品红不褪色,F中产生白色沉淀,能证明H2SO3的酸性强于HClO,据此分析.
(2)A中制备二氧化硫,Na2SO3+H2SO4(浓)═Na2SO4+H2O+SO2↑.二氧化硫为酸性气体,X干燥二氧化硫,选用浓硫酸,C中检验SO2与Na2O2反应是否有氧气,将带火星的木条放在D试管口处,看木条是否复燃,D中氢氧化钠溶液吸收剩余的二氧化硫,防止污染空气.E装置检验I-还原性弱于SO2,SO2+I2+2H2O=2I-+SO42-+4H+,F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气.
①过氧化钠与低价态的非金属氧化物发生化合反应,生成该非金属的最高价态的含氧酸盐,此时没有氧气产生;
②③根据氧化还原反应中,还原剂的还原性强于还原产物判断,淀粉与碘水作用显示蓝色,当二氧化硫还原碘单质为碘离子时,蓝色褪去;
④F装置验证二氧化硫为酸性气体,并吸收二氧化硫,防止污染空气,酚酞在碱性溶液中为红色.
解答 解:(1)①SO2易溶于水,常温常压下溶解度为1:40,二氧化硫溶于水与水反应生成亚硫酸,亚硫酸为二元弱酸,存在如下平衡SO2+H2O?H2SO3?H++HSO3-,NaHSO3属于盐,在水中完全电离,加入NaHSO3固体增加了c( HSO3-),平衡左移,降低了SO2的溶解度,
故答案为:SO2的水溶液中存在如下平衡SO2+H2O?H2SO3?H++HSO3-加入NaHSO3固体增加了c( HSO3-),平衡左移,降低了SO2的溶解度;
②要证明H2SO3的酸性强于HClO,因为二氧化硫与次氯酸根离子发生氧化还原反应,不能直接通入漂白粉溶液中,证明酸性H2SO3>H2CO3>HClO即可:应先用二氧化硫制备二氧化碳(A利用盐酸和亚硫酸氢钠反应制取二氧化硫,C通过饱和的亚硫酸氢钠洗去二氧化硫中的氯化氢,通过B二氧化硫和水反应生成亚硫酸,亚硫酸和碳酸氢钠反应制取二氧化碳),制备的二氧化碳中有二氧化硫,故通入漂白粉之前除去二氧化硫气体(E用酸性高锰酸钾除去二氧化硫),再用品红检验二氧化硫是否除净(D用品红检验),再通入漂白粉中(F),故顺序为:A→C→B→E→D→F;能证明H2SO3的酸性强于HClO的实验现象为D中品红不褪色,F中产生白色沉淀,
故答案为:C→B→E→D→F;D中品红不褪色,F中产生白色沉淀;
(2)①过氧化钠具有氧化性,二氧化硫既有氧化性又有还原性,且属于酸性气体,根据过氧化钠和二氧化碳酸性氧化物之间的反应知道,过氧化钠可以和二氧化硫之间反应生成亚硫酸钠和氧气,但是氧气能将亚硫酸钠氧化为硫酸钠,所以可能发生的化学反应方程式为:Na2O2+SO2=Na2SO4,
故答案为:Na2O2+SO2=Na2SO4;
②③E中的离子方程式为:SO2+I2+2H2O=2I-+SO42-+4H+,该反应中二氧化硫为还原剂,碘离子为还原产物,氧化还原反应中,还原剂的还原性强于还原产物,能说明I-还原性弱于SO2,现象为:E中溶液蓝色褪去,
故答案为:E中溶液蓝色褪去; SO2+I2+2H2O=2I-+SO42-+4H+;
④酚酞在碱性溶液中为红色,F中反应为2OH-+SO2═SO32-+H2O,碱性减弱,所以F中红色变浅或褪色,
故答案为:F中红色变浅或褪色.
点评 本题考查了二氧化硫性质及检验,题目难度中等,注意掌握二氧化硫的化学性质及检验方法,正确分析题干信息为解答本题的关键,试题培养了学生的分析、理解能力及化学实验能力.

| A. | 氢氧化铁胶体带正电 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 由于胶体是一种介稳性的分散系,因此不易聚沉 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
| A. | 铝溶于氢氧化钠溶液:Al+2OH-+H2O═A1O2-+2H2↑ | |
| B. | 用H2O2从酸化的海带灰浸出液中提取碘:2I-+H2O2═I2+2OH- | |
| C. | 将等体积等物质的量浓度的NaHCO3溶液与Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O | |
| D. | 向苯酚钠溶液中通入少量的CO2:2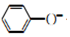 +CO2+H2O→2 +CO2+H2O→2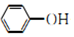 +CO${\;}_{3}^{2-}$ +CO${\;}_{3}^{2-}$ |
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴KSCN溶液,振荡 | 溶液呈血红色 | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,滴加几滴K3[Fe(CN)6]溶液,振荡 | 产生蓝色沉淀 | 存在Fe2+ |
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S (g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3④2S(g)═S2(g)△H4
则△H4的正确表达式为( )
| A. | △H4=(△H1+△H2-3△H3)×$\frac{1}{3}$ | B. | △H4=(3△H3-△H1-△H2)×$\frac{2}{3}$ | ||
| C. | △H4=(△H1+△H2-3△H3)×$\frac{2}{3}$ | D. | △H4=(△H1-△H2-3△H3)×$\frac{3}{2}$ |
| A. | 5、9、6 | B. | 4、9、6 | C. | 3、9、7 | D. | 5、9、10 |
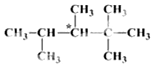 人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题:
人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题: 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答:
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答: