题目内容
5.化学与社会、生产、生活密切相关.下列说法正确的是( )| A. | 明矾、漂白粉、臭氧的净水原理相同 | |
| B. | 用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐不涉及化学变化 | |
| C. | 煤的干馏和石油的分馏都属于物理变化 | |
| D. | 亚硝酸钠是一种食品防腐剂,使用时其用量可以不加限制 |
分析 A.根据明矾、漂白粉、臭氧的净水原理分析;
B.依据胶体的渗析性质解答;
C.有新物质生成的变化为化学变化,没有新物质生成的属于物理变化;
D.亚硝酸有毒,过量使用会使人中毒.
解答 解:A.明矾的净水原理:铝离子水解生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性,吸附水中的悬浮物;所以能净水,漂白粉的净水原理:漂白粉与空气接触后,会和二氧化碳水反应生成碳酸钙和次氯酸,次氯酸具有强氧化性,可用于杀菌消毒;臭氧的净水原理:利用自身的强氧化性杀菌消毒;三者的原理各不相同,故A错误;
B.用鸡蛋壳膜和蒸馏水除去淀粉胶体中的食盐为渗析过程,没有新物质生成是物理变化,故B正确;
C.煤的干馏有新物质生成属于化学变化,石油的分馏没有新物质生成属于物理变化,故C错误;
D.亚硝酸钠是一种食品防腐剂,但是亚硝酸钠有毒,所以使用时其用量可以应严格限制,故D错误;
故选:B.
点评 本题主要考查了物质的组成、净水原理、物理变化与化学变化等,熟悉胶体的性质、物理变化与化学变化的概念是解题关键,题目难度不大.

练习册系列答案
相关题目
16.下列有关气体摩尔体积的说法中正确的是( )
| A. | 在标准状况下,1 mol任何物质的体积都约为22.4 L | |
| B. | 在标准状况下,0.5 mol任何气体的体积都约为11.2 L | |
| C. | 在常温常压下,1 mol任何气体的体积都约为22.4 L | |
| D. | 在标准状况下,0.5 mol CCl4所占有的体积约为11.2 L |
13.铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2$\frac{\underline{\;高温\;}}{\;}$2PbO+2SO2;③制粗铅:PbO+C$\frac{\underline{\;高温\;}}{\;}$Pb+CO;PbO+CO$\frac{\underline{\;高温\;}}{\;}$Pb+CO2.下列说法正确的是( )
| A. | 将1 mol PbS冶炼成Pb理论上至少需要6 g碳 | |
| B. | 浮选法富集方铅矿的过程属于化学变化 | |
| C. | 方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO | |
| D. | 整个冶炼过程中,制取1 mol Pb共转移2 mol电子 |
20.下列实验操作正确且能达到相应实验目的是( )
| 实验目的 | 实验操作 | |
| A | 称取2.0gNaOH固体 | 先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
| B | 配制MgCl2、AlCl3溶液中分别通入氨气 | 比较镁、铝的金属性强强弱 |
| C | 检验溶液中是否含有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
| D | 向NaBr溶液中滴入少量的氯水和CCl2,振荡、静置,溶液下层呈橙红色 | Cl-的还原性强于Br- |
| A. | A | B. | B | C. | C | D. | D |
10.足量浓硫酸与mg铜反应得到标准状况下SO2nL,则被还原的酸是( )
| A. | $\frac{m}{32}$ mol | B. | $\frac{2m}{64}$ mol | C. | $\frac{98n}{22.4}$ g | D. | $\frac{64n}{22.4}$g |
15.关于胶体和溶液的叙述中正确的是( )
| A. | 氢氧化铁胶体带正电 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 由于胶体是一种介稳性的分散系,因此不易聚沉 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
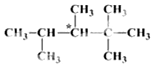 人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题:
人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题: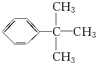 ;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种.
;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种. .
.