题目内容
6.下列离子方程式正确的是( )| A. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| B. | Mg(OH)2与H2SO4反应:Mg2++2OH-+2H++SO42-═MgSO4↓+2H2O | |
| C. | 镁与醋酸反应 Mg+2H+═Mg2++H2↑ | |
| D. | Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O |
分析 A.反应后溶液为中性,硫酸氢钠与氢氧化钡的物质的量之比为2:1,氢离子、氢氧根离子的系数错误;
B.氢氧化镁为难溶物,离子方程式中不能拆开,硫酸镁为易溶物,离子方程式中应该拆开;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.酸性高锰酸钾溶液具有强氧化性,能够氧化亚硫酸钠.
解答 解:A.NaHSO4溶液与Ba(OH)2溶液反应至中性,硫酸氢钠与氢氧化钡的物质的量之比为2:1,正确的离子方程式为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,故A错误;
B.Mg(OH)2与H2SO4反应生成硫酸镁和水,正确的离子方程式为:Mg(OH)2+2H+═Mg2++2H2O,故B错误;
C.镁与醋酸反应生成醋酸镁和氢气,醋酸不能拆开,正确的离子方程式为:Mg+2CH3COOH═Mg2++2CH3COO-+H2↑,故C错误;
D.Na2SO3溶液与酸性KMnO4溶液发生氧化还原反应,导致溶液褪色,反应的离子方程式为:5SO32-+6H++2MnO4-═5SO42-+2Mn2++3H2O,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
16.下列有关气体摩尔体积的说法中正确的是( )
| A. | 在标准状况下,1 mol任何物质的体积都约为22.4 L | |
| B. | 在标准状况下,0.5 mol任何气体的体积都约为11.2 L | |
| C. | 在常温常压下,1 mol任何气体的体积都约为22.4 L | |
| D. | 在标准状况下,0.5 mol CCl4所占有的体积约为11.2 L |
11.在测定硫酸铜晶体结晶水含量的实验中,下列操作会引起测.屋结果偏小的是( )
| A. | 加热前称量时坩埚未完全干燥 | B. | 加热时间过长,晶体部分变黑 | ||
| C. | 加热过程中有少量晶体溅出 | D. | 在空气中冷却 |
15.关于胶体和溶液的叙述中正确的是( )
| A. | 氢氧化铁胶体带正电 | |
| B. | 胶体加入电解质可产生沉淀,而溶液不能 | |
| C. | 由于胶体是一种介稳性的分散系,因此不易聚沉 | |
| D. | 胶体能够发生丁达尔现象,而溶液则不能 |
19.在1200℃时,天然气脱硫工艺中会发生下列反应
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S (g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3④2S(g)═S2(g)△H4
则△H4的正确表达式为( )
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S (g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3④2S(g)═S2(g)△H4
则△H4的正确表达式为( )
| A. | △H4=(△H1+△H2-3△H3)×$\frac{1}{3}$ | B. | △H4=(3△H3-△H1-△H2)×$\frac{2}{3}$ | ||
| C. | △H4=(△H1+△H2-3△H3)×$\frac{2}{3}$ | D. | △H4=(△H1-△H2-3△H3)×$\frac{3}{2}$ |
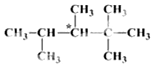 人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题:
人们将有机物中连有四个不同原子(或原子团)的碳原子称为手性碳原子,如图所示烷烃X中含有一个手性碳原子(用*标记).回答下列问题: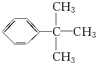 ;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种.
;乙能被高锰酸钾酸性溶液氧化为分子式C8H6O4的羧酸,则乙可能的结构有9种. .
. 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答:
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示.试回答: