题目内容
11.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | Na2S溶液中:K+、Cu2+、SO42- | |
| B. | 饱和氯水中:Na+、SO42-、Br- | |
| C. | 1.0mol•L-1的KNO3溶液中:Fe2+、H+、Cl- | |
| D. | c(OH-)/c(H+)=1×1014溶液中:Ba2+、AlO2-、NO3- |
分析 A.与S2-反应的离子不能大量共存;
B.氯水具有强氧化性;
C.酸性条件下,硝酸根离子具有强氧化性;
D.c(OH-)/c(H+)=1×1014溶液呈碱性.
解答 解:A.Cu2+与S2-反应生成沉淀而不能大量共存,故A错误;
B.氯水具有强氧化性,Br-不能大量共存,故B错误;
C.酸性条件下,硝酸根离子具有强氧化性,Fe2+不能大量共存,故C错误;
D.c(OH-)/c(H+)=1×1014溶液呈碱性,碱性条件下离子之间不发生任何反应,可大量共存,故D正确.
故选D.
点评 本题考查离子的共存,为高频考点,侧重考查学生的分析能力,把握习题中的信息及常见离子之间的反应为解答的关键,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
2.下列物质的沸点变化顺序正确的是( )
| A. | CH4>SiH4>GeH4>SnH4 | B. | NH3<PH3<AsH3<SbH3 | ||
| C. | H2O>H2S>H2Se>H2Te | D. | HCl<HBr<HI<HF |
19.化学源于生活又用之生活,下列叙述正确的是( )
| A. | 日常生活中使用的硬币都是纯金、白银打造的 | |
| B. | 塑化剂对人体有害,不可用于食品添加剂 | |
| C. | SO2可用于漂白纸张,亦可漂白日常生活中食的馒头 | |
| D. | “药毒三分”其实是没有科学依据的,只要有效超剂里也无所谓 |
6.下列说法正确的是( )
| A. | 恒温恒压容器中,反应A(s)+2B(g)?2C(g)达平衡后,再通入气体C,平衡不移动,气体B的浓度保持不变 | |
| B. | 恒温恒容容器中,通入一定量的N2O4,反应N2O4?2NO2(g)达平衡后,再通入N2O4,平衡正向移动,再达平衡时N2O4的转化率增大 | |
| C. | 恒温下,向密闭容器中加入NH2COONH4固体,反应NH2COONH4(s)?2NH3(g)+CO2(g)达平衡后,缩小容器的容积,再达平衡时,CO2的浓度不变 | |
| D. | 恒温恒容容器中,N2(g)+3H2(g)?2NH3(g)达平恒后,改变条件使平衡正向移动,再达平衡时NH3的体积分数一定增大 |
16.室温下,下列溶液中微粒的物质的量浓度关系正确的是( )
| A. | 等体积、等物质的量浓度的Na2SO3溶液与NaHSO3溶液混合后溶液呈酸性,则:c(HSO3-)>c(SO32-) | |
| B. | 0.1mol•L-1的CH3COONa溶液20mL与0.1mol•L-1的稀盐酸10mL混合后溶液显酸性:c(CH3COO-)>c (Cl-)>c(H+)>c(CH3COOH) | |
| C. | c(NH4+)浓度相同的NH4Cl、(NH4)2SO4、(NH4)2CO3溶液中,溶质的物质的量浓度:c[(NH4)2SO4]>c[(NH4)2CO3]>c(NH4Cl) | |
| D. | 0.1mol•L-1NaNO3溶液与0.1mol•L-1CH3COOH溶液以任意比例混合:c(H+)=c(OH-)+c(CH3COO-) |
2. 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.
(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3的热化学方程式为3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1.
②已知Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼易吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠.试写出五羰基铁吸收H2的反应方程式Fe(CO)5+H2=H2Fe(CO)4+CO.
③利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式CO-2e-+4OH-=CO32-+2H2O.
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
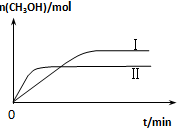
测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ大于KⅡ(填“大于”、“等于”或“小于”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为0.4<c≤1 .
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3的热化学方程式为3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1.
②已知Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼易吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠.试写出五羰基铁吸收H2的反应方程式Fe(CO)5+H2=H2Fe(CO)4+CO.
③利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式CO-2e-+4OH-=CO32-+2H2O.
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ大于KⅡ(填“大于”、“等于”或“小于”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
19.下列反应的反应热△H>0的是( )
| A. | 铁与稀硫酸反应 | B. | 加热氧化银冶炼银 | ||
| C. | 醋酸与氨水反应 | D. | 管道煤气燃烧 |
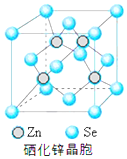 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.