题目内容
19.下列反应的反应热△H>0的是( )| A. | 铁与稀硫酸反应 | B. | 加热氧化银冶炼银 | ||
| C. | 醋酸与氨水反应 | D. | 管道煤气燃烧 |
分析 反应热△H>0,说明该反应为吸热反应,反应物总能量小于生成物总能量;
根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数置换以及某些复分解(如铵盐和强碱),据此进行解答.
解答 解:A.Fe盐酸反应是金属与酸反应,是常见放热反应,该反应的△H<0,故A错误;
B.加热氧化银冶炼银的反应为吸热反应,该反应的△H>0,故B正确;
C.醋酸与氨水的反应是中和反应,属于放热反应,该反应的△H<0,故C错误;
D.管道煤气燃烧是燃烧反应,是常见的放热反应,该反应的△H<0,故D错误;
故选B.
点评 本题考查反应热与焓变的应用,题目难度不大,抓住中学化学中常见的吸热或放热的反应是解题的关键,试题侧重基础知识的考查,有利于提高学生的灵活应用能力.

练习册系列答案
相关题目
10. 在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
 在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )
在探索苯结构的过程中,人们写出了符合分子式“C6H6”的多种可能结构(如图),下列说法正确的是( )| A. | 1~5对应的结构均能与氢气在一定条件下发生加成反应 | |
| B. | 1~5对应的结构中的一氯取代物只有1种的有3个 | |
| C. | 1~5对应的结构中所有原子均可能处于同一平面的有1个 | |
| D. | 1~5对应的结构中能使溴的四氯化碳溶液褪色的有4个 |
11.常温下,下列各组离子一定能在指定溶液中大量共存的是( )
| A. | Na2S溶液中:K+、Cu2+、SO42- | |
| B. | 饱和氯水中:Na+、SO42-、Br- | |
| C. | 1.0mol•L-1的KNO3溶液中:Fe2+、H+、Cl- | |
| D. | c(OH-)/c(H+)=1×1014溶液中:Ba2+、AlO2-、NO3- |
7.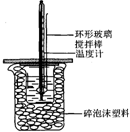 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
(1)大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失.
(2)不能(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒.其原因是金属导热,导致热量散失.
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是偏低(填“偏高”“偏低”或“无影响”).
(4)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”“减少”或“不变”),理由是后者生成0.055molH2O,而前者只能生成0.050molH2O;所求中和热数值不变(填“增加”“减少”或“不变”),理由是中和热是指酸跟碱发生中和反应生成1molH2O时所放出的热量,与酸碱的用量无关;
(5)不能(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值.该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
已知盐酸、NaOH溶液密度近似为1.00g/cm3,中和后混合液的比热容c=4.184×10-3kJ/(g•℃),则该反应的中和热为△H=-56.5kJ/mol(保留小数点后一位).
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失.
(2)不能(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒.其原因是金属导热,导致热量散失.
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是偏低(填“偏高”“偏低”或“无影响”).
(4)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”“减少”或“不变”),理由是后者生成0.055molH2O,而前者只能生成0.050molH2O;所求中和热数值不变(填“增加”“减少”或“不变”),理由是中和热是指酸跟碱发生中和反应生成1molH2O时所放出的热量,与酸碱的用量无关;
(5)不能(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值.该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
14. 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
①2H++2e-═H2 ②O2+2H2O+4e-═4OH-③4OH-═O2+2H2O+4e-.
 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )①2H++2e-═H2 ②O2+2H2O+4e-═4OH-③4OH-═O2+2H2O+4e-.
| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
4.下列表示对应化学反应的离子方程式正确的是( )
| A. | HCO3-水解的离子方程式:HCO3-+H2O?CO32-+H3O+ | |
| B. | 碘水中通入适量的SO2:I2+SO2+2H2O═2I-+SO42-+4H+ | |
| C. | 过量的SO2通入NaOH溶液中:SO2-+2OH-=SO32-+H2O | |
| D. | 硝酸银溶液中滴加过量氨水:Ag++NH3•H2O═AgOH↓+NH4+ |
11.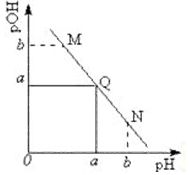 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )| A. | 溶液导电能力M点大于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | 图中b>7 |
9.有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实验步骤 | 解释或实验结论 |
| (1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)该有机物分子中含有羟基、羧 基各1mol,羟基的电子式为 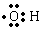 . . |
(4)A的核磁共振氢谱如图: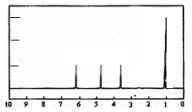 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式 , , | |
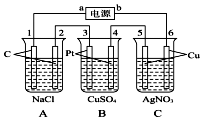 如图,通电5min后,电极5的质量增加2.16g,回答:
如图,通电5min后,电极5的质量增加2.16g,回答: