题目内容
20. 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.(1)基态硒原子的价层电子排布式为4s24p4.
(2)锗、砷、硒的第一电离能大小排序为.H2SeO4的酸性比H2SeO3的强,其原因是H2SeO4分了中非羟基氧数大于H2SeO3.
(3)H2SeO3的中心原子杂化类型是sp3;H2SeO3的立体构型是三角锥形.与H2SeO3互为等电体的分子有(写一种物质的化学式即可)CCl4(或SiF4).
(4)H2Se属于极性 (填“极性”或“非极性”)分子;单质硒的熔点为217℃,它属于分子 晶体.
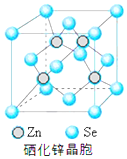
(5)硒化锌(SnSe)是一种重要的半导体材料,其晶胞结构如图所示,该晶胞中硒原子的配位数为4;若该晶胞密度为ρg•cm-3,硒化锌的摩尔质量为M g/mol.NA代表阿伏加德罗常数,则晶胞参数a为$\root{3}{\frac{4M}{ρ{N}_{A}}}$×1010pm.
分析 (1)硒为34号元素,有6个价电子,据此书写价层电子排布式;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素;同主族,从上到下,元素的第一电离逐渐减小;含氧酸分子中非羟基氧越多,酸性越强;
(3)根据中心原子的价层电子对数可判断杂化方式及微粒的立体构型,等电子体是指价电子和原子数都相等的微粒;
(4)H2Se分子中有孤电子对,据此判断分子的极性;根据晶体的性质可判断晶体的类型;
(5)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,该晶胞中含有硒原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有锌原子数为4,根据$ρ=\frac{m}{V}$可计算出晶胞的体积,进而确定晶胞的边长.
解答 解:(1)硒为34号元素,有6个价电子,所以硒的价层电子排布式为4s24p4,
故答案为:4s24p4;
(2)同一周期中,元素的第一电离能随着原子序数增大而呈增大趋势,但第ⅤA族元素第一电离能大于相邻元素,所以Ge、As、Se三种元素的第一电离能的大小顺序是:As>Se>Ge,含氧酸分子中非羟基氧越多,酸性越强,H2SeO4分了中非羟基氧数大于H2SeO3,所以H2SeO4的酸性比H2SeO3的强,
故答案为:As>Se>Ge;H2SeO4分了中非羟基氧数大于H2SeO3;
(3)H2SeO3的中心原子的价层电子对数为$\frac{6+2}{2}$=4,所以Se杂化方式为sp3杂化,SeO32-的中心原子Se的价层电子对数为$\frac{6+2}{2}$=4,离子中有一个孤电子对,所以SeO32-的立体构型是 三角锥形,等电子体是指价电子和原子数都相等的微粒,与SeO42-互为等电体的分子有CCl4(或SiF4),
故答案为:sp3; 三角锥形;CCl4(或SiF4);
(4)H2Se分子中有孤电子对,所以H2Se属于 极性分子,单质硒的熔点为217℃,比较小,所以它属于分子晶体,
故答案为:极性;分子;
(5)根据硒化锌晶胞结构图可知,每个锌原子周围有4个硒原子,每个硒原子周围也有4个锌原子,所以硒原子的配位数为4,该晶胞中含有硒原子数为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,含有锌原子数为4;根据$ρ=\frac{m}{V}$=$\frac{\frac{4M}{{N}_{A}}}{V}$,所以V=$\frac{4M}{ρ{N}_{A}}$,则晶胞的边长为$\root{3}{\frac{4M}{ρ{N}_{A}}}$cm=$\root{3}{\frac{4M}{ρ{N}_{A}}}×1{0}^{10}pm$,
故答案为:4;$\root{3}{\frac{4M}{ρ{N}_{A}}}$×1010.
点评 本题考查了价电子排布、原子轨道的杂化、等电子体、分子的极性、分子的空间构型、晶胞的计算等知识,注意把握微粒空间构型的判断方法,侧重对学生综合能力的考查,题目难度中等.

| A. | Na2S溶液中:K+、Cu2+、SO42- | |
| B. | 饱和氯水中:Na+、SO42-、Br- | |
| C. | 1.0mol•L-1的KNO3溶液中:Fe2+、H+、Cl- | |
| D. | c(OH-)/c(H+)=1×1014溶液中:Ba2+、AlO2-、NO3- |
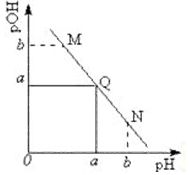 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )| A. | 溶液导电能力M点大于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | 图中b>7 |
| A. | 除去乙烷中少量的乙烯:气体通过盛酸性高锰酸钾溶液的洗气瓶 | |
| B. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤、分液、干燥、蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙醇中少量的乙酸:加足量生石灰、蒸馏 |
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
| 实验步骤 | 解释或实验结论 |
| (1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)该有机物分子中含有羟基、羧 基各1mol,羟基的电子式为 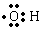 . . |
(4)A的核磁共振氢谱如图: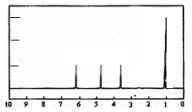 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式 , , | |
| A. | 6.4g铜在足量的氯气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,2.24L乙醇中含有的氧原子数为0.1NA | |
| C. | 2.0gH218O与D216O的混合物中所含质子数为NA | |
| D. | 0.1L0.5 mol•L-1CH3COOH溶液中含有的H+数为0.05NA |
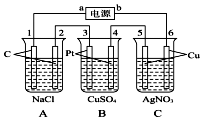 如图,通电5min后,电极5的质量增加2.16g,回答:
如图,通电5min后,电极5的质量增加2.16g,回答: