题目内容
2. 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3的热化学方程式为3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1.
②已知Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼易吸收H2生成氢化羰基铁.氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠.试写出五羰基铁吸收H2的反应方程式Fe(CO)5+H2=H2Fe(CO)4+CO.
③利用燃烧反应可设计成CO/O2燃料电池(以KOH溶液为电解液),写出该电池的负极反应式CO-2e-+4OH-=CO32-+2H2O.
(2)某实验将CO2和H2充入一定体积的密闭容器中,在两种不同条件下发生反应:
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1
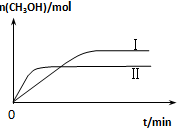
测得CH3OH的物质的量随时间变化如下图所示,回答问题:
①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ大于KⅡ(填“大于”、“等于”或“小于”).
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡.
| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、c molCH3OH(g)、c molH2O(g) |
分析 (1)①依据热化学方程式和盖斯定律计算得到热化学方程式;
②氢化羰基铁为二元弱酸,结合原子守恒分析书写化学方程式;
③CO-O2燃料电池(以KOH溶液为电解液),依据原电池原理,负极失电子发生氧化反应,燃料在负极失电子发生氧化反应;
(2)①依据图象分析可知先拐先平,温度高,反应是放热反应,升温平衡逆向进行;
②根据平衡三段式求出甲中平衡时各气体的物质的量,然后根据平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行来判断范围.
解答 解:(1)①已知:a、Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ•mol-1
b、C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律a-b×3得到:3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1,
故答案为:3CO(g)+Fe2O3(s)=2Fe(s)+3CO(g)△H=-28.5kJ•mol-1;
②Fe与CO可形成五羰基铁[Fe(CO)5],该化合物相当活泼,易于吸收H2生成氢化羰基铁,氢化羰基铁为二元弱酸,可与NaOH反应生成四羰基铁酸二钠,依据题干信息推知,反应的化学方程式为:Fe(CO)5+H2=H2Fe(CO)4+CO,
故答案为:Fe(CO)5+H2=H2Fe(CO)4+CO;
③CO-O2燃料电池(以KOH溶液为电解液),一氧化碳在负极失电子发生氧化反应生成二氧化碳在溶液中生成碳酸钾,原电池负极电极反应为:CO-2e-+4OH-=CO32-+2H2O,
故答案为:CO-2e-+4OH-=CO32-+2H2O;
(2)①图象分析可知先拐先平,Ⅱ温度高,反应是放热反应,升温平衡逆向进行,平衡常数减小,所以KⅠ>KⅡ,
故答案为:大于;
②设二氧化碳反应量为x
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始量(mol):1 3 0 0
转化量(mol):x 3x x x
平衡量(mol):1-x 3-3x x x
甲中平衡后气体的压强为开始时的0.8倍,即(4-2x)/4=0.8,解得x=0.4mol,依题意:甲、乙为等同平衡,且起始时维持反应逆向进行,所以全部由生成物投料,c的物质的量为1mol,c 的物质的量不能低于平衡时的物质的量0.4mol,所以c的物质的量为:0.4<n(c)≤1mol,
故答案为:0.4<n(c)≤1.
点评 本题考查知识点较多,涉及反应热的计算、电极反应式的书写、平衡状态的判断以及外界条件对平衡移动的影响等问题,题目难度中等,本题注意把握三段式的计算方法以及平衡常数的运用.

| A. | Na2S溶液中:K+、Cu2+、SO42- | |
| B. | 饱和氯水中:Na+、SO42-、Br- | |
| C. | 1.0mol•L-1的KNO3溶液中:Fe2+、H+、Cl- | |
| D. | c(OH-)/c(H+)=1×1014溶液中:Ba2+、AlO2-、NO3- |

| A. | A、D所含元素的原子序数大小:A一定比D小 | |
| B. | A、F所含元素的原子半径大小:A一定比F大 | |
| C. | B、E含有化学键类型相同 | |
| D. | 若常温下D为固体,则B可以与NaOH溶液反应 |
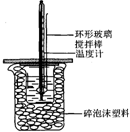 50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:
50mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液在图所示装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热.试回答下列问题:(1)大小烧杯间填满碎泡沫塑料的作用是保温、隔热,减少热量散失.
(2)不能(填“能”或“不能”)将环形玻璃搅拌棒改为环形金属(如铜)棒.其原因是金属导热,导致热量散失.
(3)大烧杯上如不盖硬纸板,对求得中和热数值的影响是偏低(填“偏高”“偏低”或“无影响”).
(4)如果改用60mL 1.0mol•L-1盐酸跟50mL 1.1mol•L-1氢氧化钠溶液进行反应,则与上述实验相比,所放热量增加(填“增加”“减少”或“不变”),理由是后者生成0.055molH2O,而前者只能生成0.050molH2O;所求中和热数值不变(填“增加”“减少”或“不变”),理由是中和热是指酸跟碱发生中和反应生成1molH2O时所放出的热量,与酸碱的用量无关;
(5)不能(填“能”或“不能”)用Ba(OH)2和硫酸代替盐酸和氢氧化钠溶液,理由是因为硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响反应的反应热.
(6)Q=cm△t,其中Q表示此中和反应放出的热量,m表示反应后混合液的质量,c表示反应后混合溶液的比热容,△t表示反应前后溶液的温度的差值.该实验小组做了三次实验,每次取溶液各50mL,并记录如下原始数据.
| 实验序号 | 起始温度t1/℃ | 终止温度/t2/℃ | 温差(t2-t1)/℃ |
| 1 | 25.0 | 32.6 | |
| 2 | 25.1 | 31.8 | |
| 3 | 25.1 | 31.9 |
(7)上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母).
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定HCl溶液的温度.
 如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )
如图装置,a为铁电极,b为石墨电极,烧杯中的物质为水或某种溶液,两电极可直接相连或接直流电源,则石墨电极上可能发生的反应有( )①2H++2e-═H2 ②O2+2H2O+4e-═4OH-③4OH-═O2+2H2O+4e-.
| A. | ① | B. | ② | C. | ①② | D. | ①②③ |
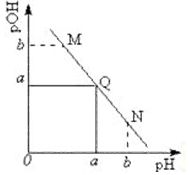 某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=-lg[OH-])与pH的变化关系如图所示,则( )| A. | 溶液导电能力M点大于Q点 | |
| B. | N点所示溶液中c(CH3COO-)>c(Na+) | |
| C. | M点和N点所示溶液中水的电离程度相同 | |
| D. | 图中b>7 |
| A. | 1 L 1 mol•L-1的NaClO 溶液中含有ClO-的数目为NA | |
| B. | 88g乙酸乙酯中存在的共价键总数为NA | |
| C. | 加热时,含2molH2SO4的浓硫酸与足量铜反应,转移的电子数为2NA | |
| D. | 1mol羟基所含的电子数为10NA |
 Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题:
Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题: 某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;
某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;