题目内容
4.铁合金及铁的化合物在生产、生活中有着重要的用途.(1)已知铁是26号元素,写出Fe2+的电子排布式1s22s22p63s23p63d6.
(2)已知三氯化铁固体在300℃以上可升华成含二聚三氯化铁(Fe2Cl6)分子的气体,该分子中所有原子均满足最外层8电子的稳定结构,则该分子的结构式为
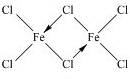 ,你认为该分子是否为平面形分子?否(填“是”或“否”).
,你认为该分子是否为平面形分子?否(填“是”或“否”).(3)六氰合亚铁酸钾K4[Fe(CN)6]俗称黄血盐,它可用做显影剂,该化合物中存在的微粒间相互作用类型有ABD(从下列选项中选填代号).
A.离子键 B.共价键 C.金属键 D.配位键 E.氢键
(4)黄血盐在溶液中可电离出极少量的CN-,CN-与CO(填一种即可)互为等电子体.CN-还可与H+结合形成一种弱酸--氢氰酸(HCN),HCN分子中碳原子的杂化轨道类型是sp,该分子的σ键和π键数目分别为2,2.
(5)黄血盐溶液与Fe3+反应可生成一种蓝色沉淀,该物质最早由1704年英国普鲁士的一家染料厂的工人发现,因此取名为普鲁士蓝,化学式可表示为K4[Fe(CN)6].研究表明它的晶体的结构特征是Fe2+、Fe3+分别占据立方体的顶点,且自身互不相邻,而CN-位于立方体的棱上与Fe2+、Fe3+配位,K+填充在上述微粒形成的部分空隙中.忽略K+,该晶体的结构示意图如下四幅图所示:
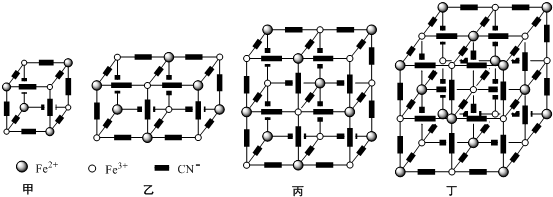
根据图可得普鲁士蓝的化学式为KFe2(CN)6,忽略K+,上述四幅晶体结构图中,图丁是普鲁士蓝的晶胞.
分析 (1)铁是26号元素,核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子形成Fe2+;
(2)二聚三氯化铁(Fe2Cl6)分子的气体,该分子中所有原子均满足最外层8电子的稳定结构,Fe与氯原子之间形成4个共价键,有2个Cl原子形成分别与2个Fe原子之间形成2个共价键,存在配位键;铁原子和四个氯原子形成四面体结构;
(3)K4[Fe(CN)6]中阴阳离子之间存在离子键,Fe3+和CN-之间存在配位键,CN-内原子之间形成共价键;
(4)原子数目相等、价电子总数相等的微粒互为电子,CN-与CO、N2等互为等电子体;等电子体结构相似,可知HCN的结构式为H-C≡N,C原子杂化轨道数目为2,单键为σ键,三键含有1个σ键、2个π键;
(5)利用均摊法计算立方体结构中Fe3+、Fe2+、CN-数目,结合电荷守恒计算K+数目,进而确定其化学式;
晶胞为其最小重复单位,一般情况下,晶胞都是平行六面体.整块晶体可以看成是无数晶胞无隙并置而成的,要求晶胞的立方体八个顶点微粒相同.
解答 解:(1)铁是26号元素,核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级2个电子形成Fe2+,Fe2+离子的核外电子排布式为:1s22s22p63s23p63d6,
故答案为:1s22s22p63s23p63d6;
(2)二聚三氯化铁(Fe2Cl6)分子的气体,该分子中所有原子均满足最外层8电子的稳定结构,Fe与氯原子之间形成4个共价键,有2个Cl原子形成分别与2个Fe原子之间形成2个共价键,存在配位键,所以其结构式为 ;
;
该分子中每个铁原子生成四个共价键,则铁原子和四个氯原子形成四面体结构,则该分子不是平面形结构,
故答案为 ;否;
;否;
(3)K4[Fe(CN)6]中阴阳离子之间存在离子键,Fe3+和CN-之间存在配位键,CN-内原子之间形成共价键,
故答案为:ABD;
(4)原子数目相等、价电子总数相等的微粒互为电子,CN-与CO、N2等互为等电子体;等电子体结构相似,可知HCN的结构式为H-C≡N,C原子杂化轨道数目为2,所以碳原子为sp杂化,单键为σ键,三键含有1个σ键、2个π键,分子中含有22个σ键、2个π键,
故答案为:CO;sp;2,2;
(5)立方体结构中Fe3+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$,Fe2+离子的个数为:4×$\frac{1}{8}$=$\frac{1}{2}$,CN-离子的个数为:12×$\frac{1}{4}$=3,
根据电荷守恒:N(K+)+N(Fe3+)×3+N(Fe2+)×2=N(CN-),得N(K+)=$\frac{1}{2}$,
普鲁士蓝中 n(K+):n(Fe3+):n(Fe2+):n(CN-)=1:1:1:6,则其化学式为KFe2(CN)6;
晶胞为其最小重复单位,一般情况下,晶胞都是平行六面体.整块晶体可以看成是无数晶胞无隙并置而成的,要求晶胞的立方体八个顶点微粒相同,图象中丁符合,
故答案为:KFe2(CN)6;丁.
点评 本题考查了物质结构和性质,涉及晶胞的计算、等电子体、原子的杂化方式、配合物等知识点,掌握均摊法进行晶胞计算,识记中学常见晶胞结构,难度中等.

| A. | 单质铁与水蒸气的反应 | B. | 铝片与氢氧化钠溶液的反应 | ||
| C. | 过氧化钠与二氧化碳的反应 | D. | 碳酸钠溶液与稀盐酸的反应 |
| A. | 4 g重水中所含质子数为2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 铜与足量浓硫酸共热放出4.48 LSO2时,消耗的铜原子数为0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
①Si(s)+3HCl(g)$\frac{\underline{\;一定条件\;}}{\;}$SiHCl3(g)+H2(g)
②SiHCl3(g)+H2(g)$\frac{\underline{\;一定条件\;}}{\;}$Si(s)+3HCl(g)
对上述反应下列说法中不正确的是( )
| A. | 制备的晶体硅可用于制作计算机芯片 | |
| B. | 该法制备高纯硅,可以综合利用氯气和氢气,使原料循环利用,生产成本低,效率高 | |
| C. | 该过程是把硅转化为SiHCl3与杂质分离,而后用氢气还原得到高纯硅 | |
| D. | 整个制备过程中若混有氧气可以不除去 |
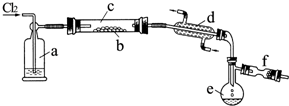 氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).
氯化硫(S2Cl2)是一种黄红色液体,有刺激性、窒息性恶臭,熔点为-80℃,沸点137.1℃.在空气中强烈发烟,易与水发生水解反应.人们使用它作橡胶硫化剂,使橡胶硫化,改变生橡胶热发粘冷变硬的不良性能.在熔融的硫中通入氯气即可生成S2Cl2.如图是实验室用S和Cl2制备S2Cl2的装置(夹持装置、加热装置均已略去).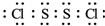 .
. 铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.
铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.