题目内容
14.短周期元素W、X、Y、Z 原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体.下列说法正确的是( )| A. | Y的最高价氧化物对应水化物的酸性比W的强 | |
| B. | W的气态氢化物比X的稳定 | |
| C. | 离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) | |
| D. | WX2与ZY2中的化学键类型相同 |
分析 短周期元素W、X、Y、Z 的原子序数依次增大,W的单质是空气中体积分数最大的气体,则W为N元素;Z最外层电子数等于最内层电子数,原子序数大于N元素,只能处于第三周期,故Z为Mg元素;X、Y、Z的简单离子的电子层结构相同,结构原子序数可知,X只能处于第二周期,且最外层电子数大于5,W(氮元素)与Y最外层电子数之和为X的最外层电子数的2倍,则Y原子最外层电子数只能为奇数,结合原子序数可知,Y不可能处于ⅠA族,只能处于ⅦA族,故Y为F元素,X最外层电子数为$\frac{5+7}{2}$=6,则X为O元素,以此解答该题.
解答 解:短周期元素W、X、Y、Z 的原子序数依次增大,W的单质是空气中体积分数最大的气体,则W为N元素;Z最外层电子数等于最内层电子数,原子序数大于N元素,只能处于第三周期,故Z为Mg元素;X、Y、Z的简单离子的电子层结构相同,结构原子序数可知,X只能处于第二周期,且最外层电子数大于5,W(氮元素)与Y最外层电子数之和为X的最外层电子数的2倍,则Y原子最外层电子数只能为奇数,结合原子序数可知,Y不可能处于ⅠA族,只能处于ⅦA族,故Y为F元素,X最外层电子数为$\frac{5+7}{2}$=6,则X为O元素,
A.Y为F元素,无正价,不存在最高价氧化物,故A错误;
B.非金属性O>N,故氢化物稳定性H2O>NH3,故B错误;
C.W、X、Y、Z 的离子具有相同的结构,核电荷数越大离子半径越小,则离子半径r(W)>r(X)>r(Y)>r(Z),故C正确;
D.OF2中含有共价键,MgF2中含有离子键,二者化学键类型不同,故D错误;
故选C.
点评 本题考查结构性质位置关系应用,为高考常见题型,题目难度中等,推断元素是解题关键,注意利用奇偶性判断Y可能所在的族,对学生的逻辑推理有一定的要求,试题培养了学生的分析能力及灵活应用能力.

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )
常温下,取浓度均为0.01mol•L-1的HA溶液和MOH溶液各20mL,分别用0.01mol•L-1NaOH溶液、0.01mol•L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示.下列说法正确的是( )| A. | HA和MOH均为弱电解质 | |
| B. | 曲线a中,滴加溶液到20mL时,c(Cl-)=c(M+)=c(OH-)=c(H+) | |
| C. | 曲线b中,滴加溶液到20mL时,c(Na+)>c(A-)>c(OH-)>c(H+) | |
| D. | 曲线b中,滴加溶液到10mL时,c(A-)+c(OH-)=c(H+)+c(HA) |
| A. | 1mol/L或5mol/L | B. | 3mol/L或5mol/L | C. | 1mol/L或3mol/L | D. | 3mol/L或7mol/L |
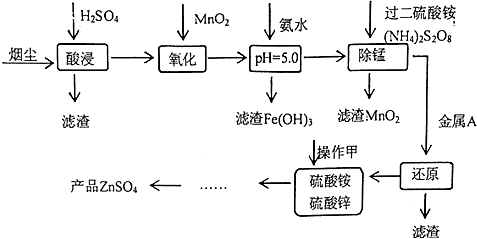
已知:
①20℃时,0.1mol.L-1的金属离子沉淀时的pH
| pH | Fe3+ | Zn2+ | Mn2+ | Cu2+ |
| 开始沉淀 | 1.9 | 6.0 | 8.1 | 4.7 |
| 沉淀完全 | 3.7 | 8.0 | 10.1 | 6.7 |
| 沉淀溶解 | 不溶解 | 10.5 | 不溶解 | / |
③ZnSO4+4NH3═[Zn(NH3)4]SO4,[Zn(NH3)4]SO4易溶于水.
回答下列问题:
(1)为提高烟尘中金属离子的浸出率,除了适度增加硫酸浓度外,还可以采取什么措施?(举出1种)升高温度.
(2)上述流程测得溶液pH=5.0,此处可以选择的测量仪器是pH计.
(3)加入MnO2的目的是将Fe2+氧化成Fe3+.
(4)写出过二硫酸铵把硫酸锰(MnSO4)氧化的化学方程式MnSO4+(NH4)2S2O8+2H2O=MnO2+(NH4)2SO4+2H2SO4.
(5)写出还原过程发生的主要反应的离子方程式Zn+Cu2+=Zn2++Cu.
(6)操作甲中为使锌离子完全沉淀,添加的最佳试剂是C
A.锌粉 B.氨水 C.( NH4)2CO3 D.NaOH
(7)若pH=5.0时,溶液中的Cu2+尚未开始沉淀,求溶液中允许的Cu2+浓度的最大值10-1.6mol/L.
| A. | 4 g重水中所含质子数为2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 铜与足量浓硫酸共热放出4.48 LSO2时,消耗的铜原子数为0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
| A. | F2和Br2的沸点 | |
| B. | H-和Be2+的离子半径 | |
| C. | 同温下分别在100g水中最多能溶解的无水CuSO4的质量和CuSO4•5H2O的质量 | |
| D. | 在NH3+NO→N2+H2O反应中,被氧化和被还原的N原子数 |
| A. | 1 mol熔融的KHSO4中含有2 NA个阳离子 | |
| B. | 1 L 0.1 mol/LCH3COONa溶液中,阴离子总数小于0.1 NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA | |
| D. | 与常温常压下17g H2O2所含非极性键数目相同的N2H4的分子总数为0.5NA |
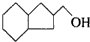
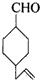
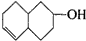
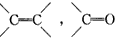 的不饱和度均为1,现有结构简式为
的不饱和度均为1,现有结构简式为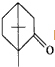 的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )
的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )