题目内容
10.硫酸铜是一种应用极其广泛的化工原料,由于铜不能与稀硫酸直接反应,实验中将铜加入浓硫酸,加热使之反应完全(装置如图1、2所示).再通过一定的操作得到硫酸铜晶体.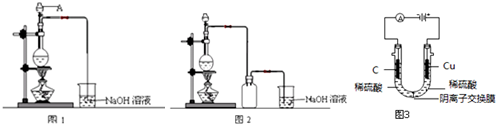
(1)仪器A的名称为分液漏斗
(2)写出铜与浓硫酸反应的化学方程式Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
(3)写出烧杯中发生反应的离子反应方程式SO2+2OH-=SO32-+H2O
(4)装置图2与图1相比的优点是增加了防倒吸装置
(5)为符合绿色化学的要求,某研究性学习小组进行如下设计:
将铜与稀硫酸混合,同时加入试剂X,可生成硫酸铜溶液.则X可以是ad(填序号).
a.热空气 b.FeCl3 c.KNO3 d.H2O2
(6)在不加入试剂X的情况下,某同学利用电解法也制得了硫酸铜溶液.装置如图3:写出石墨电极上发生的电极反应式2H++2e-=H2↑
(7)写出由硫酸铜稀溶液制得硫酸铜晶体的操作方法为加热浓缩、冷却结晶、过滤.
分析 (1)根据仪器A的构造可知A为分液漏斗;
(2)铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和和水;
(3)烧杯中盛有氢氧化钠溶液,用于吸收有毒的二氧化硫气体;
(4)根据二氧化硫与氢氧化钠溶液反应,易发生倒吸现象分析;
(5)根据“符合绿色化学”要求:不产生污染气体、不引进杂质进行分析;
(6)根据电解池工作原理分析,阳极发生氧化反应,阴极发生还原反应;
(7)实验目的是“硫酸铜稀溶液制得硫酸铜晶体”分析操作方法.
解答 解:(1)根据图示可知,仪器A为分液漏斗,
故答案:分液漏斗;
(2)铜与浓硫酸加热反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)二氧化硫有毒,需要用碱液吸收,所以烧杯中发生反应的离子方程式为:SO2+2OH-=SO32-+H2O,
故答案为:SO2+2OH-=SO32-+H2O;
(4)由于二氧化硫与氢氧化钠溶液反应,易发生倒吸现象,应该使用防倒吸装置,图示装置中图2与图1相比的优点是增加了防倒吸装置,
故答案为:增加了防倒吸装置;
(5)将铜与稀硫酸混合,同时加入试剂X,可生成硫酸铜溶液,由于铜与稀硫酸不反应,需要加入具有氧化性的试剂,且不能产生污染气体,可以用a.热空气、d.H2O2,不能选用b.FeCl3(引进杂质)、c.KNO3 (生成污染气体、引进杂质),
故答案为:a、d;
(6)装置图3中,铜连接电源正极,为电解池的阳极,则铜电解失去电子生成铜离子,石墨电极连接电源负极,为电解池的阴极,则石墨电解上氢离子得到电子生成氢气,发生的电极反应式:2H++2e-=H2↑,
故答案为:2H++2e-=H2↑;
(7)硫酸铜稀溶液制得硫酸铜晶体,温度过高无法得到硫酸铜晶体,所以需要通过加热浓缩、冷却结晶、过滤的操作方法获得硫酸铜晶体,
故答案为:加热浓缩、冷却结晶、过滤.
点评 本题考查了制备方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,涉及实验方案的评价、实验装置的理解与评价、常用化学用语、物质推断、实验条件控制、电解原理等知识,注意掌握制备方案设计与评价原则,明确电解原理、化学实验基本操作方法,试题培养了学生的分析能力及化学实验能力.

| A. | 与氢氧化钠反应的氯气一定为0.16 mol | |
| B. | n(Na+):n(Cl-)可能为7:3 | |
| C. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
| A. | 0.10mol H2O含有含有原子数为0.3NA | |
| B. | 1molCu和足量热浓硫酸反应可生成NA个SO3分子 | |
| C. | 0.10mol•L-1Na2CO3溶液中含有Na+0.2NA | |
| D. | 14g CO和N2的混合气体中含有的分子数为NA |
| A. | 单质铁与水蒸气的反应 | B. | 铝片与氢氧化钠溶液的反应 | ||
| C. | 过氧化钠与二氧化碳的反应 | D. | 碳酸钠溶液与稀盐酸的反应 |
| A. | 1mol/L或5mol/L | B. | 3mol/L或5mol/L | C. | 1mol/L或3mol/L | D. | 3mol/L或7mol/L |
| A. | 4 g重水中所含质子数为2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 铜与足量浓硫酸共热放出4.48 LSO2时,消耗的铜原子数为0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |

| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
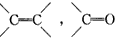 的不饱和度均为1,现有结构简式为
的不饱和度均为1,现有结构简式为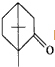 的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )
的物质,通过碳、氢原子和不饱和度的计算,确定下列物质中不是上述物质的同分异构体的是( )