题目内容
9.W、X、Y、Z为原子序数依次增大的短周期主族元素,它们的最外层电子数总和为12,W属于非金属元素且与X同主族,X+、Y3+均与氖原子电子层结构相同.下列说法正确的是( )| A. | 单质的还原性:W>X>Y | |
| B. | 原子半径:X>Y>Z>W | |
| C. | X的最高价氧化物对应水化物的碱性比Y的弱 | |
| D. | 化合物XYW4具有强氧化性 |
分析 W、X、Y、Z为原子序数依次增大的短周期主族元素,X+、Y3+均与氖原子电子层结构相同,则X为Na、Y为Al元素;W属于非金属元素且与X同主族,则W为H元素,这四种元素的最外层电子数总和为12,则Z为7,且原子序数大于Y,所以Z为Cl元素;
A.在金属活动性顺序表中,根据金属金属活动性顺序表判断这几种单质的还原性强弱;
B.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.化合物NaAlH4具有强还原性.
解答 解:W、X、Y、Z为原子序数依次增大的短周期主族元素,X+、Y3+均与氖原子电子层结构相同,则X为Na、Y为Al元素;W属于非金属元素且与X同主族,则W为H元素,这四种元素的最外层电子数总和为12,则Z为7,且原子序数大于Y,所以Z为Cl元素;
A.在金属活动性顺序表中,根据金属金属活动性顺序表判断这几种单质的还原性强弱,所以单质的还原性X>Y>W,故A错误;
B.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径:X>Y>Z>W,故B正确;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性X>Y,所以X的最高价氧化物对应水化物的碱性比Y的强,故C错误;
D.化合物NaAlH4中H元素具有还原性,故D错误;
故选B.
点评 本题考查原子结构和元素周期律,为高频考点,侧重考查学生分析判断能力,明确原子结构、元素周期表结构、元素周期律是解本题关键,知道元素金属性、非金属性强弱判断方法,题目难度不大.

练习册系列答案
相关题目
19.设NA为阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 4 g重水中所含质子数为2NA | |
| B. | 在H2O2+Cl2═2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| C. | 铜与足量浓硫酸共热放出4.48 LSO2时,消耗的铜原子数为0.2NA | |
| D. | 8.0 gCu2S和CuO的混合物中含有铜原子数为0.1NA |
20.一定条件下苯可被臭氧氧化,发生如下化学反应:则二甲苯通过上述反应得到的产物有( )种.


| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
17.下列说法正确的是( )
| A. | 氯气与明矾处理水的原理完全相同 | |
| B. | 从海水中提取物质都必须通过化学反应才能实现 | |
| C. | 植物通过光合作用将二氧化碳转化为糖是太阳能转变成热能的过程 | |
| D. | 铝比铁活泼,但铝制品比铁制品在空气中耐腐蚀 |
18.150℃时,在固定容积的密闭容器中将1L气态混合烃与9L氧气(足量)混合点燃,恢复到原温度时容器内压强为原来的108%,则原混合烃组成可能是( )
| A. | 甲烷与乙烷体积比为1:4 | B. | 乙烯与丁烷体积比为4:1 | ||
| C. | 丙炔与乙炔物质的量比为4:1 | D. | 乙烯与丁烯物质的量比为1:4 |
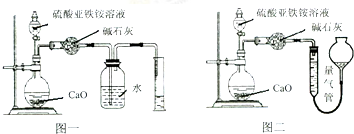
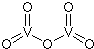 铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.
铬、钒、镨(Pr)、铈(Ce)等金属在工农业生产中有广泛的应用.
 ;
;