题目内容
18.回答下列问题: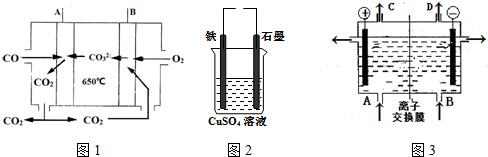
(1)如图1所示为氯碱工业的模拟装置.反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑.
A、B、C、D所对应物质化学式分别为NaCl、H2O、Cl2、H2,每通过0.1mol电子,就有0.1molNa+(填离子符号)通过离子交换膜.
(2)在如图2所示实验装置中,石墨棒上的电极反应式为4OH--4e-=2H2O+O2↑;总反应的化学方程式是2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑.
如果起始时盛有1000mL pH=5的硫酸铜溶液(25℃,CuSO4足量),一段时间后溶液的pH变为1.若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入氧化铜(或碳酸铜)(填物质名称),其质量约为4g(或6.2g)g.
(3)熔融碳酸盐CO燃料电池工作原理如图3所示,A、B极的电极反应分别是CO-2e-+CO32-=2CO2、O2+2CO2+4e-═2CO32-.
分析 (1)电解饱和食盐水,生成氢气、氯气和氢氧化钠,阳极生成氯气,阴极生成氢气和氢氧化钠,阳离子向阴极移动,A应补充NaCl,B补充水;
(2)根据电子流向判断铁做阴极,石墨做阳极,溶液中氢氧根离子在阳极失电子发生氧化反应;根据电解硫酸铜溶液的反应特征分析判断恢复溶液浓度;
(3)由于保持电解质熔融液的组成、浓度都不变,而在负极上放电的是CO,故应为CO失电子结合CO32-生成CO2;正极上放电的是二氧化碳,二氧化碳结合氧气得到电子生成碳酸根离子,原电池工作时,阴离子向负极移动,据此解答.
解答 解:(1)电解饱和食盐水,生成氢气、氯气和氢氧化钠,电解方程式为2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑,阳极生成氯气,阴极生成氢气和氢氧化钠,阳离子向阴极移动,A应补充NaCl,B补充水,电解时,阴极生成NaOH,钠离子向以及移动,每通过0.1mol电子,就有0.1molNa+,
故答案为:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑;NaCl;H2O;Cl2;H2;Na+;
(2)根据电子流动方向知,石墨是阳极、铁电极是阴极,阳极上氢氧根离子放电,石墨电极反应式为4OH--4e-=2H2O+O2↑,阴极上铜离子放电生成铜,阳极上析出氧气、阴极上析出铜,所以相当于析出CuO,电池反应式为2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑,pH=1时溶液中氢离子浓度为0.1mol/L,则溶液中n(H2SO4)=0.05mol/L×1L=0.05mol,阴极析出n(Cu)=$\frac{0.05mol}{2}$=0.05mol,根据“析出什么加入什么”原则,根据Cu原子守恒知析出m(CuO)=n(Cu).M(CuO)=0.05mol×80g/mol=4g,也可以加入碳酸铜,其质量=0.05mol×124g/mol=6.2g,
故答案为:4OH--4e-=2H2O+O2↑;2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2H2SO4+2Cu+O2↑;氧化铜(或碳酸铜);4g(或6.2g);
(3)由于保持电解质熔融液的组成、浓度都不变,而在负极上放电的是CO,故应为CO失电子结合CO32-生成CO2:CO-2e-+CO32-=2CO2;
正极上放电的是二氧化碳,二氧化碳结合氧气得到电子生成碳酸根离子,电极反应式为:O2+2CO2+4e-═2CO32-;
故答案为:CO-2e-+CO32-=2CO2;O2+2CO2+4e-═2CO32-.
点评 本题考查了原电池原理,明确电子流向、各个电极上发生的反应是解本题关键,再结合转移电子守恒、原子守恒进行计算,注意(2)题要使溶液恢复原状也可以加入碳酸铜,为易错点.

 53随堂测系列答案
53随堂测系列答案| A. | 裂解 | B. | 裂化 | C. | 分馏 | D. | 干馏 |
| A. | H2CO3?2H++CO32- | B. | CH3COOH═CH3COO-+H+ | ||
| C. | AgCl═Ag++Cl- | D. | NaHCO3═Na++H++CO32- |
| A. | 蔗糖、淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖 | |
| B. | 淀粉、纤维素、油脂、蛋白质都属于高分子化合物 | |
| C. | 利用油脂在酸性条件下的水解,可以制得甘油和肥皂 | |
| D. | 蛋白质水解的最终产物是氨基酸 |
| A. | 3:1:1 | B. | 2:2:1 | C. | 3:4:3 | D. | 7:13:5 |
| A. | 苏打不仅可用于治疗胃病,还可作灭火剂 | |
| B. | 用酸洗灼烧后的铂丝蘸取样品灼烧,火焰呈紫色,说明该样品中含钾元素 | |
| C. | 纯铁的熔点比生铁的低 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用 |
| A. | 苯酚有一定毒性,可以作消毒剂和防腐剂 | |
| B. | 油脂皂化生成的高级脂肪酸钠是肥皂的有效成分 | |
| C. | 用食醋去除水壶中的水垢时所发生的是水解反应 | |
| D. | 木糖醇是一种新型的甜味剂,适合糖尿病患者的需要 |
| A. | NF3是氧化剂,H2O是还原剂 | |
| B. | NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 | |
| C. | 一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 | |
| D. | 若生成0.2 mol HNO3,则转移0.2 mol电子 |