题目内容
13.在标准状况下,由CO、甲烷和丁烷组成的混合气体11.2L完全燃烧后,生成相同状况下的CO2气体17.92L.则原混合烃中,CO、甲烷和丁烷的体积比不可能为( )| A. | 3:1:1 | B. | 2:2:1 | C. | 3:4:3 | D. | 7:13:5 |
分析 设CO、甲烷和丁烷的物质的量为x、y、z,根据碳守恒,完全燃烧生成二氧化碳的物质的量分别为:为x、y、4z,则:$\left\{\begin{array}{l}{x+y+z=\frac{11.2L}{22.4L/mol}}\\{x+y+4z=\frac{17.92L}{22.4L/mol}}\end{array}\right.$,由此分析解答.
解答 解:设CO、甲烷和丁烷的物质的量为x、y、z,根据碳守恒,完全燃烧生成二氧化碳的物质的量分别为:为x、y、4z,则:$\left\{\begin{array}{l}{x+y+z=\frac{11.2L}{22.4L/mol}}\\{x+y+4z=\frac{17.92L}{22.4L/mol}}\end{array}\right.$,解之得z=0.1mol,所以x+y=0.4mol,则$\frac{x+y}{z}=\frac{0.4}{0.1}$=$\frac{4}{1}$,即A、B、D符合条件,而C不符合,故选C.
点评 考查常用化学计量的有关计算,难度不大,注意基础知识的理解掌握.

练习册系列答案
相关题目
3. 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
 天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )| A. | 1mol天然维生素P在一定条件下最多与7molH2加成 | |
| B. | 1mol天然维生素P和溴水反应,可消耗6molBr2 | |
| C. | 可用有机溶剂萃取 | |
| D. | 1mol维生素P可以和4mol NaOH反应 |
4.下表是元素周期表的一部分,请用化学用语回答:
(1)最高价氧化物对应的水化物中酸性最强的是HClO4.
(2)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O.
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有离子键、共价键,其电子式为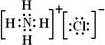 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ③ | |||||
| 三 | ④ | ⑤ | ⑥ | ⑦ | ||||
| 四 | ⑧ | ⑨ |
(2)实验室制取②的氢化物的化学方程式2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(3)④和⑤元素最高价氧化物对应的水化物相互反应的化学方程式NaOH+Al(OH)3=NaAlO2+2H2O.
(4)元素②、⑥与氢元素形成的一种化合物含有的化学键类型有离子键、共价键,其电子式为
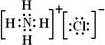 .
.
1.下列化学用语正确的是( )
| A. | 甲基的电子式: | B. | HCl的电子式: | ||
| C. | 中子数为8的碳原子:814C | D. | 丙烷分子的比例模型: |
8.下列关于碱金属某些性质的排列中正确的是( )
| A. | 密度:Li<Na<K<Rb<Cs | B. | 熔点、沸点:Li<Na<K<Rb<Cs | ||
| C. | 原子半径:Li<Na<K<Rb<Cs | D. | 氧化性:Li+<Na+<K+<Rb+<Cs+ |
5.向H2SO4溶液中加入BaCl2溶液,直到反应恰好完全为止.结果反应后溶液的质量恰好等于原BaCl2溶液的质量,则该H2SO4溶液中溶质的质量分数为( )
| A. | 50% | B. | 48.8% | C. | 42.1% | D. | 72.3% |
2.下列关于电解质的说法不正确的是( )
| A. | 一般来说,酸、碱、盐是电解质,非金属氧化物是非电解质 | |
| B. | 常见弱电解质有弱酸、弱碱、水等 | |
| C. | 强电解质的水溶液导电能力一定强,弱电解质的水溶液导电能力一定弱 | |
| D. | 蔗糖、酒精都属于非电解质 |
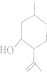 )是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).
)是合成青蒿素的重要中间体,某小组设计合成M的路线之一如图所示(部分反应条件略去).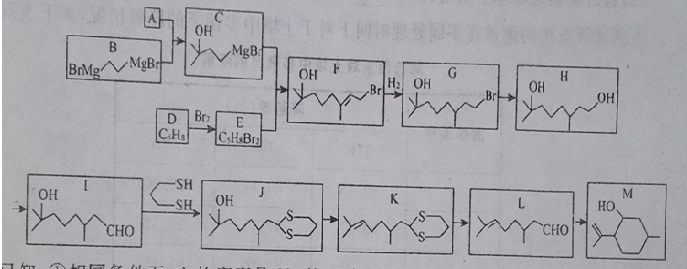
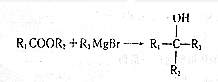
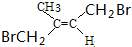 .
.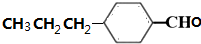 (写出其中任意一种的结构简式).
(写出其中任意一种的结构简式). 的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$
的合成路线2CH3COOCH3+BrMgCH2CH2MgBr→(CH3)C(OH)C(OH)(CH3)2$→_{△}^{浓H_{2}SO_{4}}$CH2=C(CH3)-C(CH3)=CH2$\stackrel{催化剂}{→}$