题目内容
10.某Mg、Al混合物共7.8克,加入足量盐酸,生成标准状况下的气体8.96升.再向此溶液中加入适量NaOH溶液,恰好使Mg2+、Al3+完全沉淀,求:(1)混合物中Mg、Al的物质的量各为多少?
(2)生成沉淀的质量是多少?
分析 (1)设出混合物中镁和铝的物质的量,然后分别根据总质量、生成气体体积列式计算;
(2)生成的沉淀为氢氧化镁和氢氧化铝,根据质量守恒计算出生成沉淀的质量.
解答 解:(1)设Mg的物质的量为x mol,Al的物质的量为y mol,
根据总质量可得:24x+27y=7.8…①
由Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑可得:(x+1.5y)×22.4=8.96…②,
联立①②解得:x=0.1 mol、y=0.2 mol,
答:混合物中Mg、Al的物质的量分别为0.1mol、0.2mol;
(2)生成沉淀为氢氧化铝和氢氧化铝,根据质量守恒定律可知生成沉淀的质量为:m(沉淀)=m[Mg(OH)2]+m[Al(OH)3]=0.1 mol×58g/mol+0.2 mol×78 g/mol=21.4g,
答:生成沉淀的质量巍峨21.4g.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
20.化学科学需要借助化学语言来描述,下列化学用语正确的是( )
| A. | 甲烷分子的球棍模型: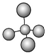 | B. | NH4Br的电子式: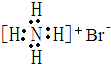 | ||
| C. | 34S2-的结构示意图: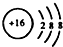 | D. | 邻羟基甲苯酸的结构简式: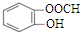 |
1.4mol•L-1的KOH溶液100mL,取出5mL,这5mL溶液中K+浓度为( )
| A. | 4 mol•L-1 | B. | 0.2mol•L-1 | C. | 2 mol•L-1 | D. | 0.4 mol•L-1 |
18.下列有关钠、铁、铝性质的说法中不正确的是( )
| A. | 在地壳中的含量:Al>Fe>Na | |
| B. | 均能与盐酸反应,但金属钠与盐酸的反应最剧烈 | |
| C. | 钠、铝均能从FeCl3溶液中置换出铁单质 | |
| D. | 钠、铝均能与NaOH溶液反应,但参加反应的物质种类前者少于后者 |
2.某温度下,一定量Cl2和100mL2mol/L氢氧化钠溶液恰好完全反应,生成的NaClO、NaClO3物质的量之比为1:3,则被还原的氯元素的质量为( )
| A. | 5.68g | B. | 7.1g | C. | 3.55g | D. | 1.42g |
19.一定量的铝溶于一定浓度的硝酸的反应中,产生标准状况下的NO气体11.2L,在所得溶液中加入足量的氨水,完全反应后过滤出沉淀,经洗涤、蒸干并充分灼烧,最后得到固体的质量为( )
| A. | 25.5g | B. | 39g | C. | 51g | D. | 106.5g |
20.分别进行下列溶液的导电性实验,灯泡最亮的是( )
| A. | 5%蔗糖溶液 | B. | 75%乙醇溶液 | ||
| C. | 0.5mol/LNaCl溶液 | D. | 1mol/LNaCl溶液 |
 ;
;