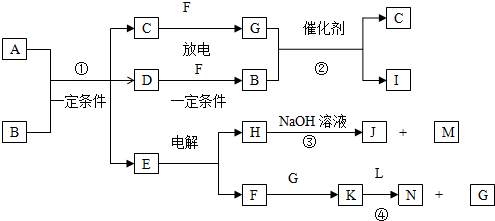
题目内容
5.现有一包固体物质,可能含有Na2CO3、Na2SO4、FeCl3、CaCl2和KNO3中的一种或几种,按下列步骤实验:①将该固体溶于水得无色透明溶液.
②向溶液中加入BaCl2溶液,有白色沉淀生成,再加足量的稀盐酸,白色沉淀部分溶解并有气泡产生,将产生的气体通入澄清石灰水中,石灰水变浑浊.
根据上述现象判断:
(1)一定存在的物质是Na2CO3、Na2SO4.
(2)一定不存在的物质是CaCl2FeCl3.
(3)可能存在的物质是KNO3.
(4)写出上述“白色沉淀部分溶解”的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O.
分析 FeCl3溶液为黄色,由①溶于水得到无色溶液可知,一定不含FeCl3;②中白色沉淀部分溶解并有气泡产生,将产生的气体通入澄清石灰水中,石灰水变浑浊,气体为二氧化碳,则一定含Na2CO3,白色沉淀为碳酸钡、硫酸钡的混合物,则原固体中含Na2CO3、Na2SO4,以此来解答.
解答 解:FeCl3溶液为黄色,由①溶于水得到无色溶液可知,一定不含FeCl3;②中白色沉淀部分溶解并有气泡产生,将产生的气体通入澄清石灰水中,石灰水变浑浊,气体为二氧化碳,则一定含Na2CO3,白色沉淀为碳酸钡、硫酸钡的混合物,则原固体中含Na2CO3、Na2SO4,
(1)由上述分析,一定存在Na2CO3、Na2SO4,故答案为:Na2CO3、Na2SO4;
(2)由①可知得到无色透明溶液,一定存在Na2CO3、Na2SO4,则不一定不存在CaCl2 FeCl3,故答案为:CaCl2 FeCl3;
(3)可能存在的物质是KNO3,故答案为:KNO3;
(4)白色沉淀为碳酸钡、硫酸钡的混合物,碳酸钡溶于盐酸,“白色沉淀部分溶解”的离子方程式为BaCO3+2H+=Ba2++CO2↑+H2O,
故答案为:BaCO3+2H+=Ba2++CO2↑+H2O.
点评 本题考查无机物的推断,为高频考点,把握溶液为无色及白色沉淀的判断为解答的关键,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
相关题目
15.下列各组物质的分类正确的是( )
| A. | 同位素:1H、D+、T2 | |
| B. | 电解质:CaCO3、CH3COOH、NH4HCO3 | |
| C. | 胶体:饱和氯化铁溶液、淀粉溶液、牛奶 | |
| D. | 硅酸盐产品:晶体硅、水泥、陶瓷 |
16.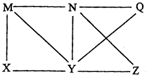 现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
 现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )
现有Al、Cl2、Al2O3、HCl(aq)、Al(OH)3、NaOH(aq)六种物质,它们之间有如图所示转化关系,图中每条线两端的物质之间都可以发生反应,下列推断不合理的是( )| A. | X可能为Al或Cl2 | B. | Y一定为NaOH(aq) | ||
| C. | N一定是HCl(aq) | D. | Q、Z中的一种必定为Al2O3 |
13.下列物质的水溶液经加热浓缩,蒸干灼烧仍能得到原物质的是( )
| A. | FeCl3 | B. | Cu(NO3)2 | C. | Na2SO3 | D. | Al2(SO4)3 |
20.实验室欲用NaOH固体配制1.00mol/L的NaOH溶液250mL,在配制过程中其他操作都是正确的,下列操作会引起所配溶液浓度偏高的是( )
| A. | 没有洗涤烧杯和玻璃棒 | |
| B. | 转移溶液时不慎有少量洒到容量瓶外面 | |
| C. | 容量瓶不干燥,含有少量蒸馏水 | |
| D. | 定容时俯视刻度线 |
17.如图所示,甲池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.下列说法正确的是( )
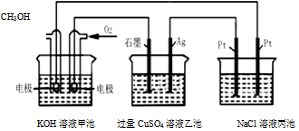

| A. | 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置 | |
| B. | 甲池通入CH3OH的电极反应为CH3OH-6e-+2H2O═CO32-+8H+ | |
| C. | 甲池中消耗280mL(标准状况下)O2,此时乙池中银极增重1.6g | |
| D. | 反应一段时间后,向丙池中加入一定量盐酸,一定能使NaCl溶液恢复到原浓度 |
15.下列关于热化学反应的描述中正确的是( )
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | 1mol甲烷燃烧生成水蒸汽和二氧化碳所放出的热量就是甲烷的燃烧热 | |
| C. | CO(g)的燃烧热△H=-283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的反应热△H=+566.0kJ/mol | |
| D. | 已知中和热△H=-57.3kJ/mol,则稀H2SO4和Ba(OH)2溶液反应生成2molH2O的反应热△H=-114.6kJ/mol |