题目内容
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是A.天然气燃烧
B.K和H2O的反应
C.Ba(OH)2?8H2O与NH4Cl的反应
D.KClO3在MnO2催化下制O2
(2)用一定浓度的稀盐酸与稀NaOH溶液在如图a所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.
①将V1 mL 1.0mol/L HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图b所示.(实验中始终保持V1+V2=50mL)下列叙述正确的是
A.做该实验时环境温度为22℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约是1.00mol/L
D.该实验表明有水生成的反应都是放热反应
②V1=30mL时HCl和NaOH恰好反应,理论上根据题中所给数据算出的温度变化值约为8℃,而根据上图的温度变化可读出温度变化值约为6℃;两者相比所测结果偏低,造成如此现象的原因有
考点:氧化还原反应,吸热反应和放热反应,中和热的测定
专题:氧化还原反应专题,化学反应中的能量变化
分析:(1)氧化还原反应的特征是元素化合价的升降,结合元素化合价的变化以及常见反应放热反应解答;
(2)①A.由图示3中信息可知V1=10mL时温度为22℃;
B.该实验中的化学反应放出热量;
C.体积不确定,则不能确定氢氧化钠浓度;
D.氢氧化钡晶体和氯化铵的反应;
②测定结果偏低,说明反应过程中热量损失.
(2)①A.由图示3中信息可知V1=10mL时温度为22℃;
B.该实验中的化学反应放出热量;
C.体积不确定,则不能确定氢氧化钠浓度;
D.氢氧化钡晶体和氯化铵的反应;
②测定结果偏低,说明反应过程中热量损失.
解答:
解:(1)A.天然气燃烧,甲烷生成二氧化碳和水,被氧化,且为放热反应,故A正确;
B.K和H2O的反应,为放热反应,生成KOH和氢气,为氧化还原反应,故B正确;
C.Ba(OH)2?8H2O与NH4Cl的反应,为吸热反应,故C错误;
D.KClO3在MnO2催化下制O2,为吸热反应,故D错误.
故答案为:AB;
(2)①A.由图示3中信息可知V1=10mL时温度为22℃,则说明实验温度小于22℃,故A错误;
B.该实验中的化学反应放出热量,故表明化学能可转化为热能,故B正确;
C.体积不确定,则不能确定氢氧化钠浓度,一般来说氢氧化钠浓度应稍大于盐酸,C错误;
D.该化学反应生成了水,但不能代表只要生成水的反应都放热,如氢氧化钡晶体和氯化铵的反应,故D错误,
故答案为:B;
②测定结果偏低,说明反应过程中热量损失,或忽略了小烧杯、温度计所吸收的热量、测量有误差,
故答案为:仪器保温性能差、实验中忽略了小烧杯、温度计所吸收的热量、测量有误差.
B.K和H2O的反应,为放热反应,生成KOH和氢气,为氧化还原反应,故B正确;
C.Ba(OH)2?8H2O与NH4Cl的反应,为吸热反应,故C错误;
D.KClO3在MnO2催化下制O2,为吸热反应,故D错误.
故答案为:AB;
(2)①A.由图示3中信息可知V1=10mL时温度为22℃,则说明实验温度小于22℃,故A错误;
B.该实验中的化学反应放出热量,故表明化学能可转化为热能,故B正确;
C.体积不确定,则不能确定氢氧化钠浓度,一般来说氢氧化钠浓度应稍大于盐酸,C错误;
D.该化学反应生成了水,但不能代表只要生成水的反应都放热,如氢氧化钡晶体和氯化铵的反应,故D错误,
故答案为:B;
②测定结果偏低,说明反应过程中热量损失,或忽略了小烧杯、温度计所吸收的热量、测量有误差,
故答案为:仪器保温性能差、实验中忽略了小烧杯、温度计所吸收的热量、测量有误差.
点评:本题考查氧化还原反应以及反应热的测定等问题,侧重于学生的分析能力和实验能力的考查,注意把握实验操作要点,难度不大.

练习册系列答案
相关题目
下列电离方程式书写错误的是( )
| A、CaCl2=Ca2++2Cl- |
| B、H2CO3?H++HCO3- |
| C、NaHCO3=Na++H++CO32- |
| D、NaClO=Na++ClO- |
下列各电离方程式中,书写正确的是( )
| A、CH3COOH?H++CH3COO- |
| B、KHSO4?H++SO42-+K+ |
| C、H2CO3?2H++CO3 2- |
| D、NaH2PO4?Na++H2PO4- |
用NA表示阿伏加德罗常数的值下列叙述正确的是( )
| A、0.1mol Na生成Na202时,失去的电子数为O.2NA |
| B、NA个N2与NA个H2的质量比等于14:1 |
| C、常温常压下,11.2L CO2中所占的分子数为0.5NA |
| D、4g NaOH溶解于500mL水中.所得溶液的物质的量浓度为0.2mol/L |
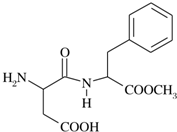 阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.
阿斯巴甜(APM)是一种甜度高、味美而热量低的甜味剂,其结构简式如图所示.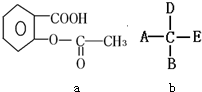 I.有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+;⑨-CH3
I.有9种微粒:①NH2-;②-NH2;③Br-;④OH-;⑤-NO2;⑥-OH;⑦NO2;⑧CH3+;⑨-CH3
