题目内容
用NA表示阿伏加德罗常数的值下列叙述正确的是( )
| A、0.1mol Na生成Na202时,失去的电子数为O.2NA |
| B、NA个N2与NA个H2的质量比等于14:1 |
| C、常温常压下,11.2L CO2中所占的分子数为0.5NA |
| D、4g NaOH溶解于500mL水中.所得溶液的物质的量浓度为0.2mol/L |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A.金属钠为1价金属,0.1mol钠完全反应失去0.1mol电子;
B.分子数相同,氮气与氢气的质量比等于其摩尔质量之比;
C.常温常压下,不能使用标况下气体摩尔体积计算二氧化碳的物质的量;
D.4g氢氧化钠溶于500mL水中,所得溶液体积不是500mL.
B.分子数相同,氮气与氢气的质量比等于其摩尔质量之比;
C.常温常压下,不能使用标况下气体摩尔体积计算二氧化碳的物质的量;
D.4g氢氧化钠溶于500mL水中,所得溶液体积不是500mL.
解答:
解:A.0.1mol钠完全反应失去0.1mol电子,失去的电子数为O.1NA,故A错误;
B.NA个N2与NA个H2的质量比等于其摩尔质量之比,即:28g/mol:2g/mol=14:1,故B正确;
C.不是标准状况下,题中条件无法计算11.2L二氧化碳的物质的量,故C错误;
D.氢氧化钠溶于水500mL中,所得溶液体积不是500mL,所得溶液浓度不是0.2mol/L,故D错误;
故选B.
B.NA个N2与NA个H2的质量比等于其摩尔质量之比,即:28g/mol:2g/mol=14:1,故B正确;
C.不是标准状况下,题中条件无法计算11.2L二氧化碳的物质的量,故C错误;
D.氢氧化钠溶于水500mL中,所得溶液体积不是500mL,所得溶液浓度不是0.2mol/L,故D错误;
故选B.
点评:本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,选项D为易错点,注意所得溶液体积情况.

练习册系列答案
 发散思维新课堂系列答案
发散思维新课堂系列答案
相关题目
取金属Na、Mg、Al各0.1mol,分别投入均盛有100mL 0.5mol/L盐酸的烧杯中,充分反应后放出H2的体积( )
| A、一样多 | B、Na最多 |
| C、Mg最多 | D、Al最多 |
下列装置或操作能达到实验目的是( )
A、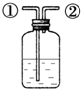 用排饱和食盐水法收集氯气,瓶内装饱和食盐水,氯气从①口进,②口出 |
B、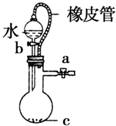 该装置中橡皮管的作用是能使水顺利流下 |
C、 除去苯中的己烷 |
D、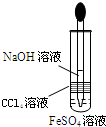 制备Fe(OH)2 |
下列有关实验装置进行的相应实验,能达到实验目的是( )
A、 配制100mL 0.1mol?L-1的硫酸 |
B、 吸收氨气并防止倒吸 |
C、 制取少量乙烯气体 |
D、 验证溴乙烷发生消去反应 |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A、0.1mol Na2O2与足量水完全反应时,转移电子数目为0.1NA |
| B、12g金刚石含有的共价键数为2NA |
| C、0.1mol的铜与足量的浓硫酸反应生成SO2的体积(标况)约为2.24L |
| D、标况下,22.4L CH3Cl和CH2Cl2的混合物所含氯原子数介于NA至2NA之间 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A、澄清透明的溶液中:H+、Fe2+、SO42-、NO3- |
| B、使甲基橙变红的溶液中:Ca2+、NH4+、CH3COO-、Cl- |
| C、0.1 mol?L-1的BaCl2溶液中:K+、Na+、OH-、NO3- |
| D、由水电离出的c(H+)=10-12 mol?L-1的溶液中:Mg2+、K+、Br-、HCO3- |
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是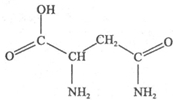 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.