题目内容
短周期元素X、Y、Z在元素周期表中的位置如图所示,其中Y元素原子的最外层电子数是电子层数的两倍.
回答下列问题:
(1)Y元素在元素周期表中的位置是 .
(2)列举一个事实证明Y元素与Z元素的非金属性强弱: .
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐.该盐溶液的pH 7,(填“<”、”=”或“>”)其原因为(用离子方程式表示) .
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体.该反应的化学方程式为 .
回答下列问题:
| X | ||
| Y | Z |
(2)列举一个事实证明Y元素与Z元素的非金属性强弱:
(3)X的气态氢化物与其最高价氧化物对应的水化物反应生成盐.该盐溶液的pH
(4)X元素的某种液态氢化物,分子中含有18个电子,只存在共价单键.该物质在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体.该反应的化学方程式为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中的位置可知X位于周期表第二周期,Y、Z位于周期表第三周期,Y元素原子的最外层电子数是电子层数的两倍,则应为S元素,可知Z为Cl,X为N元素,结合元素对应单质、化合物的性质以及元素周期律知识解答该题.
解答:
解:由元素在周期表中的位置可知X位于周期表第二周期,Y、Z位于周期表第三周期,Y元素原子的最外层电子数是电子层数的两倍,则应为S元素,可知Z为Cl,X为N元素,
(1)Y为S元素,位于周期表第三周期第VIA族,故答案为:第三周期第VIA族;
(2)比较元素的非金属性强弱,可根据最高价氧化物对应水化物的酸性或对应的氢化物的稳定性,非金属性Cl>S,则酸性:HClO4>H2SO4,稳定性:HCl>H2S,
故答案为:酸性为HClO4>H2SO4,或稳定性为HCl>H2S;
(3)X为N元素,气态氢化物与其最高价氧化物对应的水化物反应生成盐为硝酸铵,为强酸弱碱盐,水解呈酸性,溶液pH<7,发生NH4++H2O═NH3?H2O+H+,
故答案为:<; NH4++H2O═NH3?H2O+H+;
(4)NX元素的某种液态氢化物,分子中含有18个电子,只存在共价单键,应为N2H4,在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体,应生成N2,发生氧化还原反应,反应的方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O,
故答案为:N2H4+4CuO=N2↑+2Cu2O+2H2O.
(1)Y为S元素,位于周期表第三周期第VIA族,故答案为:第三周期第VIA族;
(2)比较元素的非金属性强弱,可根据最高价氧化物对应水化物的酸性或对应的氢化物的稳定性,非金属性Cl>S,则酸性:HClO4>H2SO4,稳定性:HCl>H2S,
故答案为:酸性为HClO4>H2SO4,或稳定性为HCl>H2S;
(3)X为N元素,气态氢化物与其最高价氧化物对应的水化物反应生成盐为硝酸铵,为强酸弱碱盐,水解呈酸性,溶液pH<7,发生NH4++H2O═NH3?H2O+H+,
故答案为:<; NH4++H2O═NH3?H2O+H+;
(4)NX元素的某种液态氢化物,分子中含有18个电子,只存在共价单键,应为N2H4,在碱性溶液中能够将CuO还原为Cu2O,同时生成一种参与大气循环的气体,应生成N2,发生氧化还原反应,反应的方程式为N2H4+4CuO=N2↑+2Cu2O+2H2O,
故答案为:N2H4+4CuO=N2↑+2Cu2O+2H2O.
点评:本题考查位置结构性质的相互关系应用,为高频考点和常见题型,侧重于学生的分析能力的考查,题目难度中等,正确推断元素的种类为解答该题的关键,注意原子结构和元素周期表的关系.

练习册系列答案
相关题目
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料 ⑥废电池进行集中回收处理.
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料 ⑥废电池进行集中回收处理.
| A、①③⑤⑥ | B、②③⑤⑥ |
| C、①②④ | D、②④⑤ |
NA为阿伏加德罗常数,下列叙述错误的是( )
| A、0.1mol Na2O2与足量水完全反应时,转移电子数目为0.1NA |
| B、12g金刚石含有的共价键数为2NA |
| C、0.1mol的铜与足量的浓硫酸反应生成SO2的体积(标况)约为2.24L |
| D、标况下,22.4L CH3Cl和CH2Cl2的混合物所含氯原子数介于NA至2NA之间 |
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是


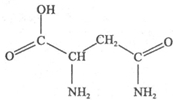 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.