题目内容
下列各电离方程式中,书写正确的是( )
| A、CH3COOH?H++CH3COO- |
| B、KHSO4?H++SO42-+K+ |
| C、H2CO3?2H++CO3 2- |
| D、NaH2PO4?Na++H2PO4- |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:先判断强电解质与弱电解质,强电解质在溶液中完全电离,其电离方程式用等号,弱电解质在溶液中部分电离,用可逆号,多元弱酸的电离分步进行,主要以第一步为主,据此进行解答.
解答:
解:A.醋酸为弱电解质,溶液中电离出醋酸根离子和氢离子,电离方程式为:CH3COOH?H++CH3COO-,故A正确;
B.硫酸氢钾为强电解质,溶液完全电离,用等号,正确的电离方程式为:KHSO4=H++SO42-+K+,故B错误;
C.碳酸为二元弱酸,电离过程分步进行,主要以第一步为主,碳酸的电离方程式为:H2CO3?H++HCO3-,故C错误;
D.磷酸二氢钠为强电解质,溶液中完全电离,不能使用可逆号,正确的电离方程式为:NaH2PO4=Na++H2PO4-,故D错误;
故选A.
B.硫酸氢钾为强电解质,溶液完全电离,用等号,正确的电离方程式为:KHSO4=H++SO42-+K+,故B错误;
C.碳酸为二元弱酸,电离过程分步进行,主要以第一步为主,碳酸的电离方程式为:H2CO3?H++HCO3-,故C错误;
D.磷酸二氢钠为强电解质,溶液中完全电离,不能使用可逆号,正确的电离方程式为:NaH2PO4=Na++H2PO4-,故D错误;
故选A.
点评:本题考查了电离方程式的书写判断,题目难度中等,主要掌握弱电解质与弱电解质的概念,明确电离方程式的书写原则,选项C为易错点,注意碳酸的电离分步进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
设NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A、22.4LCO和CO2的混合气体中所含的碳原子数一定是NA |
| B、常温常压下,32gO2和32gO3所含氧原子数都是2NA |
| C、1molFe与足量盐酸反应,Fe所失去的电子数为3NA |
| D、l00mLlmol/LNaCl溶液与50mL1mol/LAlCl3溶液中Cl-物质的量浓度相等 |
 如图所示,铅蓄电池是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-
如图所示,铅蓄电池是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42-| 放电 |
| 充电 |
| A、放电时,正极反应是Pb-2e-+SO42-=PbSO4 |
| B、放电时,外电路中电子流动方向由B到A |
| C、放电时,铅蓄电池的负极质量增加,正极质量减小 |
| D、充电时,该装置中化学能转化为电能 |
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料 ⑥废电池进行集中回收处理.
①加快化石燃料的开采与使用;②研发易降解的生物农药;③应用高效洁净的能源转换技术;④田间焚烧秸秆;⑤推广使用节能环保材料 ⑥废电池进行集中回收处理.
| A、①③⑤⑥ | B、②③⑤⑥ |
| C、①②④ | D、②④⑤ |
目前,城市污水处理厂多采用活性污泥法二级处理工艺来进行污水处理.该工艺的一级处理是在沉淀池中通过过滤除去污水中固体沉淀物和悬浮物,再加入一定量的化学试剂中和酸性或碱性物质.二级处理是采用空气曝气活性污泥法,利用细菌等微生物除去废水中的有机污染物.在这种污水处理工艺中,采用的污水处理方法有( )
①化学法 ②生物法 ③物理法.
①化学法 ②生物法 ③物理法.
| A、①② | B、②③ | C、①③ | D、①②③ |
欲将蛋白质从水中析出而又不改变它的性质,应加入( )?
| A、甲醛溶液 |
| B、饱和Na2SO4溶液 |
| C、饱和(NH4)2SO4溶液 |
| D、醋酸铅溶液 |
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是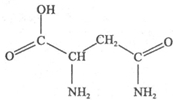 天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.
天冬酰胺(结构如图)在芦笋中含量丰富,具有提高身体免疫力的功效.