题目内容
镁、铝、铁及其化合物在生产、生活中有着广泛的应用
I:实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:

(1)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)2]=3×10-34,该温度下向浓度均为0.01mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成 沉淀(填化学式).
(2)高温焙烧时发生反应的化学方程式 ,洗涤沉淀时的方法是 .
(3)常温下如果向AlCl3饱和溶液中不断通人HCl气体,可析出AlCl3?6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: .
Ⅱ:某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.为此,他们设计了如下装置验证所产生的气体.

(1)G装置的作用是 .
(2)证明有SO2生成的现象是 ,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 、 .
(3)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是 .
I:实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:

(1)已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)2]=3×10-34,该温度下向浓度均为0.01mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成
(2)高温焙烧时发生反应的化学方程式
(3)常温下如果向AlCl3饱和溶液中不断通人HCl气体,可析出AlCl3?6H2O晶体,结合化学平衡移动原理解释析出晶体的原因:
Ⅱ:某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.为此,他们设计了如下装置验证所产生的气体.

(1)G装置的作用是
(2)证明有SO2生成的现象是
(3)若将铁丝换成铜丝,反应后的溶液没有出现预计的蓝色溶液,而出现了大量白色固体,原因是
考点:物质分离和提纯的方法和基本操作综合应用,常见金属元素的单质及其化合物的综合应用,物质分离、提纯的实验方案设计,制备实验方案的设计
专题:实验设计题
分析:Ⅰ(1)难溶电解质的溶度积越小,加入氨水时越易生成沉淀;(2)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应的化学方程式2Al(OH)3+Mg(OH)2
MgAl2O4+4H2O,洗涤沉淀时的方法是 向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次;(3)氯化氢抑制氯化铝溶Ⅱ(1)如果没有G装置,水蒸气进入F装置干扰实验,(2)二氧化硫有还原性,能使酸性高锰酸钾溶液褪色,
氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色;
(3)因为浓硫酸中的水很少,反应后生成的硫酸铜大多没有溶解出现预计的蓝色溶液,而出现了大量白色固体.
| ||
氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色;
(3)因为浓硫酸中的水很少,反应后生成的硫酸铜大多没有溶解出现预计的蓝色溶液,而出现了大量白色固体.
解答:
解:Ⅰ(1)难溶电解质的溶度积越小,加入氨水时越易生成沉淀,已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34,氢氧化铝先沉淀,
故答案为:Al(OH)3;
(2)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应的化学方程式2Al(OH)3+Mg(OH)2
MgAl2O4+4H2O,洗涤沉淀时的方法是 向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次,
故答案为:2Al(OH)3+Mg(OH)2
MgAl2O4+4H2O; 向漏斗中加水至浸没沉淀,待水自然流干后,再重复2-3次;
(3)氯化铝在溶液中存在溶解平衡,通入氯化氢后溶液中氯离子浓度增大,抑制氯化铝溶解,所以促进氯化铝晶体析出,
故答案为:AlCl3饱和溶液中存在溶解平衡:AlCl3?6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体.
Ⅱ(1)如果没有G装置,水蒸气进入F装置干扰实验,所以G的作用是:防止空气中的H2O进入F,故答案为:防止空气中的水进入F;
(2)二氧化硫有还原性,酸性高锰酸钾有强氧化性,二者能发生氧化还原反应而使酸性高锰酸钾溶液褪色;氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 氧化铜、无水硫酸铜,
故答案为:酸性高锰酸钾溶液颜色褪色;氧化铜;无水硫酸铜;
(3)因为浓硫酸中的水很少,反应后生成的硫酸铜大多没有溶解出现预计的蓝色溶液,而出现了大量白色固体,故答案为:浓硫酸中的水很少.
故答案为:Al(OH)3;
(2)经分析沉淀为Al(OH)3和Mg(OH)2,高温焙烧备MgAl2O4时发生反应的化学方程式2Al(OH)3+Mg(OH)2
| ||
故答案为:2Al(OH)3+Mg(OH)2
| ||
(3)氯化铝在溶液中存在溶解平衡,通入氯化氢后溶液中氯离子浓度增大,抑制氯化铝溶解,所以促进氯化铝晶体析出,
故答案为:AlCl3饱和溶液中存在溶解平衡:AlCl3?6H2O(s)?Al3+(aq)+3Cl-(aq)+6H2O(l),通入HCl气体使溶液中c(Cl-)增大,平衡向析出固体的方向移动从而析出AlCl3晶体.
Ⅱ(1)如果没有G装置,水蒸气进入F装置干扰实验,所以G的作用是:防止空气中的H2O进入F,故答案为:防止空气中的水进入F;
(2)二氧化硫有还原性,酸性高锰酸钾有强氧化性,二者能发生氧化还原反应而使酸性高锰酸钾溶液褪色;氢气有还原性能和氧化铜在加热条件下发生置换反应生成铜单质,生成的水遇无水硫酸铜时白色固体变蓝色,为了证明气体中含有氢气,装置E和F中加入的试剂分别为 氧化铜、无水硫酸铜,
故答案为:酸性高锰酸钾溶液颜色褪色;氧化铜;无水硫酸铜;
(3)因为浓硫酸中的水很少,反应后生成的硫酸铜大多没有溶解出现预计的蓝色溶液,而出现了大量白色固体,故答案为:浓硫酸中的水很少.
点评:本题考查了物质的分离与提纯、实验方案的设计、元素化和知识的综合运用等,属于拼合型题目,对学生的心理有较高的要求,掌握基础是关键,难度中等.

练习册系列答案
相关题目
下列表示对应化学反应的离子方程式正确的是( )
| A、在FeCl3溶液中投入足量的Zn粉:2Fe3++Zn═Zn2++2Fe2+ |
| B、NaHSO4溶液与Ba(OH)2溶液混合后呈中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| C、磁性氧化铁(Fe3O4)溶于氢碘酸:Fe3O4+8H+═Fe2++2Fe3++4H2O |
| D、Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
下列装置或操作能达到实验目的是( )
A、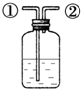 用排饱和食盐水法收集氯气,瓶内装饱和食盐水,氯气从①口进,②口出 |
B、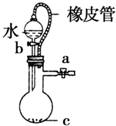 该装置中橡皮管的作用是能使水顺利流下 |
C、 除去苯中的己烷 |
D、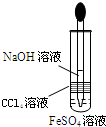 制备Fe(OH)2 |
 (1)下列反应既是氧化还原反应,又是放热反应的是
(1)下列反应既是氧化还原反应,又是放热反应的是