题目内容
氮化铝是一种新型的无机非金属材料,被广泛应用于集成电路生产领域.在氮气流中由氧化铝与焦炭在电炉中加热制得.方程式为:Al2O3+N2+3C
2AlN+3CO,反应中原料配比不当或反应不完全等因素都会造成产品中含有C、Al4C3或Al2O3等杂质.请回答下列问题:
(1)探究氮化铝与酸的反应.
步骤1:取少量样品于试管中,滴加稀H2SO4溶液至样品全部溶解;
步骤2:检验生成产物中含有NH4+;
写出AlN与稀H2SO4反应的化学方程式 .
(2)Al4C3与水反应生成甲烷,甲烷与CuO反应的化学方程式为:CH4+4CuO
CO2+2H2O+4Cu为测定产品中有关成分的含量,所需仪器如下:
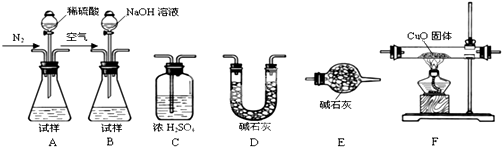
测定样品中含有少量Al4C3的含量,各装置连接的顺序为A→C→F→C→D→E.主要实验步骤如下:
①称量D的质量,按顺序组装仪器,将试样放入锥形瓶中,检查装置的气密性;
②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止;
③点燃F酒精灯;④缓缓鼓入一定量的N2;⑤再次缓缓鼓入一定量的N2;
⑥再次称量D的质量;⑦重复步骤⑤和⑥的操作,直到D的质量基本不变.
操作的先后顺序是①→→⑤→⑥→⑦.
操作④的目的是 .
(3)测定样品中AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为: → → →E
若样品质量为16.4g,称量C增重5.1g,则AlN的质量分数是 .
(4)实验室可利用Al4C3与水反应来制备甲烷,通过排饱和食盐水的方法先后各收集半量筒甲烷和半量筒氯气,用铁架台固定好,(如图)将装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到…,量筒壁上有油状液滴生成,…,水槽中有少量固体析出.

①油状液滴的成分是 (写分子式)
②饱和食盐水中有少量固体析出,其原因是 .(请结合方程式及必要的文字解释)
| ||
(1)探究氮化铝与酸的反应.
步骤1:取少量样品于试管中,滴加稀H2SO4溶液至样品全部溶解;
步骤2:检验生成产物中含有NH4+;
写出AlN与稀H2SO4反应的化学方程式
(2)Al4C3与水反应生成甲烷,甲烷与CuO反应的化学方程式为:CH4+4CuO
| ||

测定样品中含有少量Al4C3的含量,各装置连接的顺序为A→C→F→C→D→E.主要实验步骤如下:
①称量D的质量,按顺序组装仪器,将试样放入锥形瓶中,检查装置的气密性;
②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止;
③点燃F酒精灯;④缓缓鼓入一定量的N2;⑤再次缓缓鼓入一定量的N2;
⑥再次称量D的质量;⑦重复步骤⑤和⑥的操作,直到D的质量基本不变.
操作的先后顺序是①→→⑤→⑥→⑦.
操作④的目的是
(3)测定样品中AlN的含量,请选择合适的药品和装置,按气流方向连接各装置,其顺序为:
若样品质量为16.4g,称量C增重5.1g,则AlN的质量分数是
(4)实验室可利用Al4C3与水反应来制备甲烷,通过排饱和食盐水的方法先后各收集半量筒甲烷和半量筒氯气,用铁架台固定好,(如图)将装置放置在光亮的地方(日光没有直接照射),一会儿后,观察到…,量筒壁上有油状液滴生成,…,水槽中有少量固体析出.

①油状液滴的成分是
②饱和食盐水中有少量固体析出,其原因是
考点:探究物质的组成或测量物质的含量
专题:实验题
分析:(1)依据铵根离子的检验方法设计实验步骤进行检验,AlN是一种良好的耐热冲击材料,可溶解于硫酸溶液生成硫酸铝和硫酸铵;
(2)操作④是缓缓鼓入一定量的N2 ,操作的目的是利用氮气性质稳定把装置中空气赶净;依据实验装置连接顺序和测定成分发生的反应分析判断,装置中的空气需要赶净,把样品溶于稀硫酸完全反应,利用氮气把生成的甲烷全部赶到F装置反应,减少误差;
(3)依据实验装置连接顺序和测定成分发生的反应分析判断,装置中的空气需要赶净,把样品溶于稀硫酸完全反应,利用氮气把生成的甲烷全部赶到F装置反应,减少误差,氮化铝水解生成氢氧化铝和氨气,氨气是碱性气体,干燥需要用碱石灰,吸收可以用浓硫酸,最后称重计算;
(4)①油状液滴的成分是甲烷和氯气光照发生取代反应生成的取代产物,液体为二氯甲烷、三氯甲烷、四氯化碳;
②饱和食盐水中氯化钠存在沉淀溶解平衡,取代反应生成的氯化氢溶于水电离出的氯离子促进人沉淀溶解平衡逆向进行,析出氯化钠晶体.
(2)操作④是缓缓鼓入一定量的N2 ,操作的目的是利用氮气性质稳定把装置中空气赶净;依据实验装置连接顺序和测定成分发生的反应分析判断,装置中的空气需要赶净,把样品溶于稀硫酸完全反应,利用氮气把生成的甲烷全部赶到F装置反应,减少误差;
(3)依据实验装置连接顺序和测定成分发生的反应分析判断,装置中的空气需要赶净,把样品溶于稀硫酸完全反应,利用氮气把生成的甲烷全部赶到F装置反应,减少误差,氮化铝水解生成氢氧化铝和氨气,氨气是碱性气体,干燥需要用碱石灰,吸收可以用浓硫酸,最后称重计算;
(4)①油状液滴的成分是甲烷和氯气光照发生取代反应生成的取代产物,液体为二氯甲烷、三氯甲烷、四氯化碳;
②饱和食盐水中氯化钠存在沉淀溶解平衡,取代反应生成的氯化氢溶于水电离出的氯离子促进人沉淀溶解平衡逆向进行,析出氯化钠晶体.
解答:
解:(1)检验生成产物中含有NH4+,取少量样品于试管中,滴加稀H2SO4至溶液呈酸性,取反应后的溶液加入足量NaOH溶液,加热,用湿润的红色石蕊试纸检验产生的气体,若试纸变蓝,说明存在NH4+,AlN与稀H2SO4反应的化学方程式:2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4;
故答案为:2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4;
(2)若各装置连接的顺序为:A→C→F→C→D→E,称量D的质量,按顺序组装仪器,检查装置的气密性,将试样放入锥形瓶中,装置中的空气需要赶净,把样品溶于稀硫酸完全反应,利用氮气把生成的甲烷全部赶到F装置反应,CH4与CuO发生反应:CH4+4CuO
CO2+2H2O+4Cu,减少测定误差,所以需要补充的步骤为:④缓缓鼓入一定量的N2;③点燃F酒精灯;②从分液漏斗缓缓滴入稀硫酸,直到不再产生气体时为止;操作④缓缓鼓入一定量的N2,把装置中的空气排净,防止爆炸;
故答案为:④→③→②;将装置中空气排尽,防止空气中CO2对实验产生干扰,防止发生爆炸;
(3)为测定AlN的含量,分析AlN能够水解生成氢氧化铝和氨气,氨气是碱性气体,在装置B中加入样品滴入氢氧化钠溶液反应生成氨气,用装置D中碱石灰吸收水蒸气后,再用装置C中浓硫酸吸收氨气,称重计算,所以装置连接为B-D-C;若试样为16.4g,测得C增重5.1g为氨气的质量,样品中AlN的质量分数=
×100%=75%;
故答案为:B;D;C;75%;
(4)①油状液滴的成分是甲烷和氯气光照发生取代反应生成的取代产物,液体为二氯甲烷、三氯甲烷、四氯化碳;
故答案为:CH2Cl2、CHCl3、CCl4;
②饱和食盐水中氯化钠存在沉淀溶解平衡,NaCl(s)?Na+(aq)+Cl-(aq),取代反应中生成HCl溶解后电离出氯离子,使Cl-浓度增大,促使上述平衡逆向进行生成氯化钠晶体;
故答案为:NaCl(s)?Na+(aq)+Cl-(aq),反应中有HCl生成,使溶液中的Cl-浓度增大,促使上述平衡向生成NaCl固体的方向移动.
故答案为:2AlN+4H2SO4=Al2(SO4)3+(NH4)2SO4;
(2)若各装置连接的顺序为:A→C→F→C→D→E,称量D的质量,按顺序组装仪器,检查装置的气密性,将试样放入锥形瓶中,装置中的空气需要赶净,把样品溶于稀硫酸完全反应,利用氮气把生成的甲烷全部赶到F装置反应,CH4与CuO发生反应:CH4+4CuO
| ||
故答案为:④→③→②;将装置中空气排尽,防止空气中CO2对实验产生干扰,防止发生爆炸;
(3)为测定AlN的含量,分析AlN能够水解生成氢氧化铝和氨气,氨气是碱性气体,在装置B中加入样品滴入氢氧化钠溶液反应生成氨气,用装置D中碱石灰吸收水蒸气后,再用装置C中浓硫酸吸收氨气,称重计算,所以装置连接为B-D-C;若试样为16.4g,测得C增重5.1g为氨气的质量,样品中AlN的质量分数=
| ||
| 16.4g |
故答案为:B;D;C;75%;
(4)①油状液滴的成分是甲烷和氯气光照发生取代反应生成的取代产物,液体为二氯甲烷、三氯甲烷、四氯化碳;
故答案为:CH2Cl2、CHCl3、CCl4;
②饱和食盐水中氯化钠存在沉淀溶解平衡,NaCl(s)?Na+(aq)+Cl-(aq),取代反应中生成HCl溶解后电离出氯离子,使Cl-浓度增大,促使上述平衡逆向进行生成氯化钠晶体;
故答案为:NaCl(s)?Na+(aq)+Cl-(aq),反应中有HCl生成,使溶液中的Cl-浓度增大,促使上述平衡向生成NaCl固体的方向移动.
点评:本题考查了物质组成和探究方法和实验分析判断,离子检验实验步骤设计,实验步骤的理解和设计是解题关键,题目难度中等.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
下列离子方程式正确的是( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、NH4HCO3溶于过量NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C、Na与CuSO4溶液反应:2Na+Cu2++2Na+ |
| D、向FeCl3溶液中加入Mg(OH)2+2Fe3+=Fe(OH)3↓+3Mg2+ |

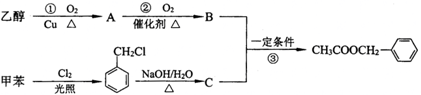
 )是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: