题目内容
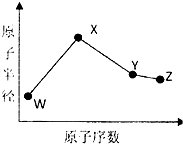 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质了、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化图所示.已知W的一种核素的质量数为14,中子数为7;X的离子与NH4+具有相同的质了、电子数目:W与Y的氧化物均能导致酸雨的形成;Z的非会属性在同周期主族元素中最强.(1)Y在周期表中的位置是
(2)用电子式表示化合物X3W的结构
(3)X3W遇水可释放出使酚酞溶液变红的气体A,该反应的化学方程式是
(4)同温同压下,将a L W的简单氢化物和b L Z的氢化物通入水中,若所得溶液的pH=7则a
(5)用惰性电极电解化合物XZ溶液从阴极释放出气休B,该反应的离子方程式是
(6)已知W的单质与气体B在一定条件下可形成气体A,即:W2(g)+3B(g)?2A(g)△H=-92.4kJ?mo1-1
在某温度时,一个容积固定的密闭容器中,发生上述反应.在不同时间测定的容器内各物质的浓度如表:
| 时间 | 浓度(mo1/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
②反应在第l0min改变了反应条件,改变的条件可能是
a.更新了催化剂 b.升高温度 c.增大压强 d.增加B的浓度
③若反应从第30min末又发生了一次条件改变,改变的反应条件可能是
a.更新了催化剂 b.升高温度 c.增大压强 d.减小A的浓度.
考点:位置结构性质的相互关系应用,化学平衡建立的过程,化学平衡的影响因素,化学平衡状态的判断
专题:元素周期律与元素周期表专题,化学平衡专题
分析:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为14,中子数为7,质子数为:14-7=7,则W为氮元素;
X的离子与NH4+具有相同的质子、电子数目,X的质子数为11,则X为Na元素;
由图可知,X、Y、Z的原子序数依次增大,都处于第三周期,Y的氧化物均能导致酸雨的形成,故Y为硫元素;
Z的非金属性在同周期主族元素中最强,故Z为Cl元素,
根据以上分析可知:W为氮元素、X为Na元素、Y为硫元素、Z为Cl元素,据此进行解答.
X的离子与NH4+具有相同的质子、电子数目,X的质子数为11,则X为Na元素;
由图可知,X、Y、Z的原子序数依次增大,都处于第三周期,Y的氧化物均能导致酸雨的形成,故Y为硫元素;
Z的非金属性在同周期主族元素中最强,故Z为Cl元素,
根据以上分析可知:W为氮元素、X为Na元素、Y为硫元素、Z为Cl元素,据此进行解答.
解答:
解:W、X、Y、Z是四种常见的短周期元素,W的一种核素的质量数为14,中子数为7,质子数为14-7=7,故W为氮元素;X的离子与NH4+具有相同的质子、电子数目,X的质子数为11,故X为Na元素;由图可知,X、Y、Z的原子序数依次增大,都处于第三周期,Y的氧化物均能导致酸雨的形成,故Y为硫元素;Z的非金属性在同周期主族元素中最强,故Z为Cl元素,
(1)Y为硫元素,原子有3个电子层,最外层电子数为6,处于周期表中第三周期第ⅥA族,
故答案为:第三周期第ⅥA族;
(2)X3W为Na3N,Na3N为离子化合物,阴阳离子都需要标出所带电荷,其电子式为: ,
,
故答案为: ;
;
(3)Na3N遇水可释放出使酚酞溶液变红的气体A,A为碱性气体,故A为NH3,由水解原理可知,还生成NaOH,反应化学方程式是:Na3N+3H2O=NH3↑+3NaOH,
故答案为:Na3N+3H2O=NH3↑+3NaOH;
(4)W为N元素、Z为Cl元素,同温同压下,将aL W的简单氢化物NH3和bL Z的氢化物HCl通入水中,当a=b时,恰好反应生成氯化铵,由于铵根离子水解溶液显示酸性,而所得溶液的pH=7,则氨气应该稍过量,则a>b,
故答案为:>;
(5)用惰性电极电解化合物NaCl溶液从阴极释放出气体B,B为H2,电解NaCl溶液生成氢气、氯气、氢氧化钠,反应的离子方程式是:2Cl-+2H2O
Cl2↑+H2↑+2OH-,
故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-;
(6)①根据表中数据可知,0min~10min W2的浓度变化为:4mol/L-3.8mol/L=0.2mol/L,则这段时间内W2的平均反应速率为:
=0.02mol/(L?min),
故答案为:0.02mol/(L?min);
②由表中数据可知,10min~20min的速率比0min~10min速率快,10min时反应未到达平衡,反应进行向正反应进行,20min与10min相比,W2、B、A的浓度变化量为分别为0.2mol/L、0.6mol/L、0.4mol/L,等于化学计量数之比,故不可能为增大某一物质浓度;
增大压强反应混合物的浓度都应增大,W2、B 浓度降低,故不可能为增大压强;
故10min时改变条件应是更新了催化剂或升高温度加快反应速率,所以ab正确,
故答案为:ab;
③由表中数据可知,20min时反应到达平衡,30min末又发生了一次条件改变,由40min时各组分的浓度可知,平衡向逆反应进行,40min与30min相比,W2、B、A的浓度变化量为分别为0.2mol/L、0.6mol/L、0.4mol/L,等于化学计量数之比,故不可能为减小某一反应物的浓度,也不可能是增大A的浓度,降低压强平衡向逆反应移动,W2、B的浓度也应该降低,故不可能为降低压强,使用催化剂,不影响平衡移动,该反应正反应为放热反应,故30min时改变条件应是升高温度,所以b正确,
故答案为:b.
(1)Y为硫元素,原子有3个电子层,最外层电子数为6,处于周期表中第三周期第ⅥA族,
故答案为:第三周期第ⅥA族;
(2)X3W为Na3N,Na3N为离子化合物,阴阳离子都需要标出所带电荷,其电子式为:
 ,
,故答案为:
 ;
;(3)Na3N遇水可释放出使酚酞溶液变红的气体A,A为碱性气体,故A为NH3,由水解原理可知,还生成NaOH,反应化学方程式是:Na3N+3H2O=NH3↑+3NaOH,
故答案为:Na3N+3H2O=NH3↑+3NaOH;
(4)W为N元素、Z为Cl元素,同温同压下,将aL W的简单氢化物NH3和bL Z的氢化物HCl通入水中,当a=b时,恰好反应生成氯化铵,由于铵根离子水解溶液显示酸性,而所得溶液的pH=7,则氨气应该稍过量,则a>b,
故答案为:>;
(5)用惰性电极电解化合物NaCl溶液从阴极释放出气体B,B为H2,电解NaCl溶液生成氢气、氯气、氢氧化钠,反应的离子方程式是:2Cl-+2H2O
| ||
故答案为:2Cl-+2H2O
| ||
(6)①根据表中数据可知,0min~10min W2的浓度变化为:4mol/L-3.8mol/L=0.2mol/L,则这段时间内W2的平均反应速率为:
| 0.2mol/L |
| 10min |
故答案为:0.02mol/(L?min);
②由表中数据可知,10min~20min的速率比0min~10min速率快,10min时反应未到达平衡,反应进行向正反应进行,20min与10min相比,W2、B、A的浓度变化量为分别为0.2mol/L、0.6mol/L、0.4mol/L,等于化学计量数之比,故不可能为增大某一物质浓度;
增大压强反应混合物的浓度都应增大,W2、B 浓度降低,故不可能为增大压强;
故10min时改变条件应是更新了催化剂或升高温度加快反应速率,所以ab正确,
故答案为:ab;
③由表中数据可知,20min时反应到达平衡,30min末又发生了一次条件改变,由40min时各组分的浓度可知,平衡向逆反应进行,40min与30min相比,W2、B、A的浓度变化量为分别为0.2mol/L、0.6mol/L、0.4mol/L,等于化学计量数之比,故不可能为减小某一反应物的浓度,也不可能是增大A的浓度,降低压强平衡向逆反应移动,W2、B的浓度也应该降低,故不可能为降低压强,使用催化剂,不影响平衡移动,该反应正反应为放热反应,故30min时改变条件应是升高温度,所以b正确,
故答案为:b.
点评:本题考查位置结构性质关系、化学用语、化学反应速率计算、化学平衡的影响因素等知识,题目难度较大,(6)中②③注意根据浓度变化结合外界条件影响解答,②中增大压强为易错点,只考虑速率加快,容易忽略浓度变化.

练习册系列答案
相关题目
10g CO和H2组成的混合气体在足量氧气中完全燃烧,立即将全部生成物通入足量的Na2O2中,则固体质量增加( )
| A、10g | B、11.8g |
| C、13.2g | D、无法计算 |
下列对化学反应的认识正确的是( )
| A、化学反应过程中,分子的种类和数目一定发生改变 |
| B、如果某化学反应的△H和△S均小于0,则反应一定能自发进行 |
| C、化学反应过程中,一定有化学键的断裂和形成 |
| D、放热反应的反应速率,一定比吸热反应的反应速率快 |
胶体区别于其他分散系的本质特征是( )
| A、外观均一、透明 |
| B、能发生丁达尔现象 |
| C、具有介稳性 |
| D、分散质粒子直径大小 |
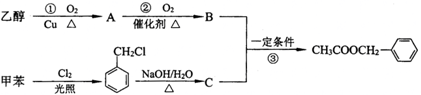
 )是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: