题目内容
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如表所示.下列说法不正确的是( )
| A、元素X与元素Z的最高正化合价之和的数值等于8 |
| B、离子Y2-和Z3+的核外电子数和电子层数均相同 |
| C、元素W的最高价氧化物对应的水化物的酸性比Q的弱 |
| D、元素X的气态氢化物的稳定性大于元素Y的气态氢化物的稳定性 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据图示元素在周期表中的位置可知,X为N元素、Y为O元素、Z为Al元素、W为S元素、Q为Cl元素,
A.N元素的最高正化合价为+5、Al元素的最高正化合价为+3;
B.Y为O元素、Z为Al元素,离子Y2-和Z3+的核外电子数都是10、电子层数均为2;
C.非金属性越强,其最高价氧化物对应的水化物的酸性越强;
D.氢化物稳定性越强,对应的气态氢化物稳定性越强.
A.N元素的最高正化合价为+5、Al元素的最高正化合价为+3;
B.Y为O元素、Z为Al元素,离子Y2-和Z3+的核外电子数都是10、电子层数均为2;
C.非金属性越强,其最高价氧化物对应的水化物的酸性越强;
D.氢化物稳定性越强,对应的气态氢化物稳定性越强.
解答:
解:根据图示可知,X为N元素、Y为O元素、Z为Al元素、W为S元素、Q为Cl元素,
A.X为N元素,最高正价为+5价,Z为Al元素,最高正价为+3价,则元素X与元素Z的最高正化合价之和的数值等于8,故A正确;
B.离子Y2-和Z3+的核外电子数都为10,离子核外有2个电子层,电子层数相同,故B正确;
C.W为S元素、Q为Cl,非金属性Q>W,非金属性越强,其最高价氧化物对应的水化物酸性越强,则元素W的最高价氧化物对应的水化物的酸性比Q的弱,故C正确;
D.X为N元素、Y为O元素,非金属性:X<Y,非金属性越强,对应的气态氢化物温度下越强,则元素X的气态氢化物的稳定性小于元素Y的气态氢化物的稳定性,故D错误;
故选D.
A.X为N元素,最高正价为+5价,Z为Al元素,最高正价为+3价,则元素X与元素Z的最高正化合价之和的数值等于8,故A正确;
B.离子Y2-和Z3+的核外电子数都为10,离子核外有2个电子层,电子层数相同,故B正确;
C.W为S元素、Q为Cl,非金属性Q>W,非金属性越强,其最高价氧化物对应的水化物酸性越强,则元素W的最高价氧化物对应的水化物的酸性比Q的弱,故C正确;
D.X为N元素、Y为O元素,非金属性:X<Y,非金属性越强,对应的气态氢化物温度下越强,则元素X的气态氢化物的稳定性小于元素Y的气态氢化物的稳定性,故D错误;
故选D.
点评:本题考查位置结构性质关系及应用,题目难度中等,注意掌握元素周期表的结构和元素周期律的递变规律,明确原子结构与元素周期表、元素周期律的关系.

练习册系列答案
相关题目
下列离子方程式正确的是( )
| A、硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ |
| B、NH4HCO3溶于过量NaOH溶液中:HCO3-+OH-=CO32-+H2O |
| C、Na与CuSO4溶液反应:2Na+Cu2++2Na+ |
| D、向FeCl3溶液中加入Mg(OH)2+2Fe3+=Fe(OH)3↓+3Mg2+ |
下列关于实验安全的叙述中不正确的是( )
| A、实验室制备有毒气体应在通风橱中进行,且必须对尾气进行吸收或处理,防止中毒或污染大气 |
| B、不慎碰倒酒精灯,洒出的酒精在桌上燃烧时,应立即用湿抹布扑盖 |
| C、氢气还原氧化铜,一般先预热氧化铜,然后通入氢气 |
| D、眼睛里不慎溅进了药液,应立即用水冲洗,边洗边眨眼睛,不可用手揉眼睛 |
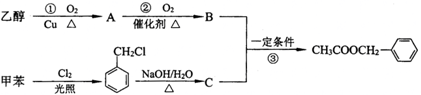
 )是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下:
)是有香味的有机化合物,它可以从茉莉花中提取,也可以用甲苯和乙醇为原料进行人工合成.一种合成路线如下: