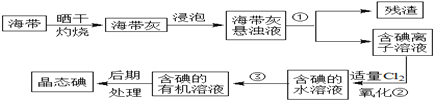
题目内容
7.常温下,如图表示向10mLpH=3的A溶液中加水稀释到V1mL溶液pH的变化.下列说法中正确的是( )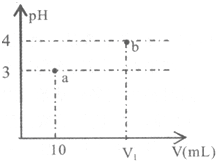
| A. | 若V1=100,则稀释前A的浓度一定是0.001mol/L | |
| B. | 若A为NH4Cl和HCl的混合溶液,则V1一定大于100 | |
| C. | a点水的电离程度一定小于b点 | |
| D. | 若A为NH4Cl和NH3•H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
分析 A.10mLpH=3的A溶液中加水稀释到V1mL溶液,PH=4,若V1=100,则是稀释10倍溶液PH增大一个单位,证明是强酸;
B.若A为NH4Cl和HCl的混合溶液,溶液中铵根离子水解溶液显酸性,加水稀释促进水解平衡正向进行;
C.向10mLpH=3的A溶液可能是酸溶液,也可能是水解的盐溶液;
D.若A为NH4Cl和NH3•H2O的混合溶液,依据溶液中电荷守恒分析判断;
解答 解:A.10mLpH=3的A溶液中加水稀释到V1mL溶液,PH=4,若V1=100,则是稀释10倍溶液PH增大一个单位,证明是强酸,但可以是一元酸也可以是二元酸,所以远酸溶液浓度不一定为0.001mol/L,故A错误;
B.若A为NH4Cl和HCl的混合溶液,溶液中铵根离子水解溶液显酸性,加水稀释促进水解平衡正向进行,加水稀释到100ml,不考虑水解平衡移动,溶液PH变化为4,单铵根离子水解,溶液PH小于4,所以V1一定大于100,故B正确;
C.向10mLpH=3的A溶液可能是酸溶液,也可能是水解的盐溶液,若为酸溶液a点水的电离程度一定小于b点,若为水解的盐溶液加入水稀释促进水解正向进行,水的电离程度减小,a点水的电离程度大于b点,故C错误;
D.若A为NH4Cl和NH3•H2O的混合溶液,溶液中存在电荷守恒c(NH4+)+c(H+)=c(OH-)+c(Cl-),溶液显酸性,则(H+)>c(OH-),c(NH4+)<c(Cl-),故D错误;
故选B.
点评 本题考查了弱电解质电离平衡、电离平衡影响因素、弱电解质溶液中稀释溶液PH变化、溶液中电荷守恒的判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
17.下列各组微粒,在溶液中可以大量共存的是( )
| A. | OH-、K+、CO32-、Cl2 | B. | Na+、OH-、NH4+、Cl- | ||
| C. | Fe3+、Na+、NH3.H2O、NO3- | D. | K+、Al3+、Cl-、SO42- |
18.科学家对物质性质的推断一般要基于一些实验事实.下列能说明苯与一般的烯烃性质不同的实验事实是( )
| A. | 苯分子是高度对称的平面形分子 | |
| B. | 苯与溴水混合无明显现象 | |
| C. | 苯不与酸性KMnO4溶液反应 | |
| D. | 1 mol C6H6在一条件下可与3 mol Cl2发生加成反应 |
2.下列化学用语的书写正确的是( )
| A. | 氮气的电子式: | B. | 硫原子的结构示意图: | ||
| C. | CH4的比例模型: | D. | 乙烯的结构简式:CH2CH2 |
19.已知乙烯醇不稳定,可自动转化成乙醛:CH2═CH-OH→CH3CHO.乙二醇在一定条件下发生脱水反应(有消去、有羟基和羟基之间反应形成“C-O-C”结构),所得产物的结构简式有人写出下列几种:
①CH2═CH2
②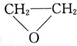
③CH3CHO
④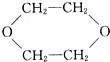
⑤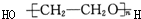
其中不可能的是( )
①CH2═CH2
②

③CH3CHO
④
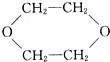
⑤
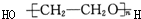
其中不可能的是( )
| A. | 只有① | B. | ②③ | C. | ③④ | D. | ④⑤ |
17.下列有关说法正确的是( )
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 质子数相同的微粒,它们的化学性质基本相同 | |
| C. | 苯和溴苯的混合物可用分液法分离 | |
| D. | 由“C(石墨)→C(金刚石)△H=+1.9 kJ/mol”可知石墨比金刚石稳定 |