题目内容
17.下列各组微粒,在溶液中可以大量共存的是( )| A. | OH-、K+、CO32-、Cl2 | B. | Na+、OH-、NH4+、Cl- | ||
| C. | Fe3+、Na+、NH3.H2O、NO3- | D. | K+、Al3+、Cl-、SO42- |
分析 根据离子之间不能结合生成沉淀、气体、水、弱电解质等,不能发生氧化还原反应等,则离子大量共存,以此来解答.
解答 解:A.OH-、Cl2发生氧化还原反应,溶液中CO32-、Cl2发生反应,不能大量共存,故A不选;
B.OH-、NH4+结合生成弱碱,不能大量共存,故B不选;
C.Fe3+、NH3.H2O结合生成沉淀,不能大量共存,故C不选;
D.该组离子之间不反应,可大量共存,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应的判断,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7. 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )
 短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )
短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上)戊、己分别是空气、地壳中含量最多的元素,下列判断正确的是( )| A. | 甲一定是金属元素 | |
| B. | 气态氰化物的稳定性庚>己>戊 | |
| C. | 乙、丙、丁的最高价氧化物对应水化物可以相互反应 | |
| D. | 庚的最高价氧化物水化物酸性最强 |
8.下列属于同位素的是( )
| A. | 镁条镁粉 | B. | 氧化钠过氧化钠 | C. | 氕氘氚 | D. | C60石墨 |
12.有下列高分子化合物:

其中由两种不同单体聚合而成的是( )

其中由两种不同单体聚合而成的是( )
| A. | ①⑤ | B. | ③④⑤ | C. | ②④⑤ | D. | ①②④ |
2.化学与生产、生活紧密相连,下列叙述正确的是( )
| A. | 石油的分馏、煤的气化属物理变化;石油的裂解、煤的干馏属化学变化 | |
| B. | 铝及合金是日常生活广泛使用的材料,通常用电解氯化铝的方法制取铝 | |
| C. | 绿色化学期望从源头消除污染,生产过程中充分利用原料,实现零排放 | |
| D. | 在江河入海口的钢铁闸门上安装铜块或锌块,均可防止钢铁闸门被腐蚀 |
9.下列关于铝及其化合物的离子方程式不正确的是( )
| A. | AlCl3溶液中加入过量稀氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO${\;}_{4}^{2-}$恰好完全沉淀:2Ba2++3OH-+Al3++2SO${\;}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
6.已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验::
(1)该实验①、②可探究温度对反应速率的影响,因此V1=V2=10.0,V3=0;
(2)若V4=10.0,V5=6.0,则实验①、③可探究浓度对反应速率的影响.
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)若V4=10.0,V5=6.0,则实验①、③可探究浓度对反应速率的影响.
7.常温下,如图表示向10mLpH=3的A溶液中加水稀释到V1mL溶液pH的变化.下列说法中正确的是( )
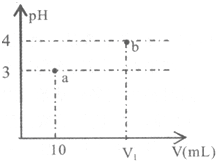

| A. | 若V1=100,则稀释前A的浓度一定是0.001mol/L | |
| B. | 若A为NH4Cl和HCl的混合溶液,则V1一定大于100 | |
| C. | a点水的电离程度一定小于b点 | |
| D. | 若A为NH4Cl和NH3•H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) |