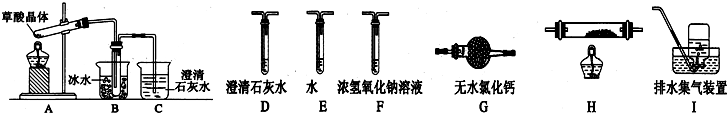
题目内容
18.科学家对物质性质的推断一般要基于一些实验事实.下列能说明苯与一般的烯烃性质不同的实验事实是( )| A. | 苯分子是高度对称的平面形分子 | |
| B. | 苯与溴水混合无明显现象 | |
| C. | 苯不与酸性KMnO4溶液反应 | |
| D. | 1 mol C6H6在一条件下可与3 mol Cl2发生加成反应 |
分析 苯分子(C6H6)尽管很不饱和但却不能与溴水反应,不能与酸性KMnO4溶液反应,这是明显不同于一般的烯烃性质的事实,以此解答该题.
解答 解:A、凯库勒式结构也是一个高度对称的平面性结构,不能说明与烯烃的性质不同,故A错误;
B、苯不溶于水,与溴水混合后溶液分层,故B错误;
C、苯中不含碳碳双键,因此不能被酸性高锰酸钾溶液氧化,故C正确;
D、苯和氯气不发生加成反应,可与氢气在一定条件下发生加成反应,故D错误;
故选C.
点评 本题考查有机物的结构和性质,侧重考查苯与烯烃结构的区别和性质的差异,题目难度不大,掌握苯的结构和性质是解题的关键,平时学习时注意不同类物质结构和性质的比较.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
8.下列属于同位素的是( )
| A. | 镁条镁粉 | B. | 氧化钠过氧化钠 | C. | 氕氘氚 | D. | C60石墨 |
9.下列关于铝及其化合物的离子方程式不正确的是( )
| A. | AlCl3溶液中加入过量稀氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH${\;}_{4}^{+}$ | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO${\;}_{2}^{-}$+2H2O═Al(OH)3↓+HCO${\;}_{3}^{-}$ | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO${\;}_{4}^{2-}$恰好完全沉淀:2Ba2++3OH-+Al3++2SO${\;}_{4}^{2-}$═2BaSO4↓+Al(OH)3↓ |
6.已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验::
(1)该实验①、②可探究温度对反应速率的影响,因此V1=V2=10.0,V3=0;
(2)若V4=10.0,V5=6.0,则实验①、③可探究浓度对反应速率的影响.
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)若V4=10.0,V5=6.0,则实验①、③可探究浓度对反应速率的影响.
13.用下列实验装置进行实验,能达到相应实验目的是( )
| A. | 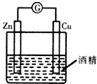 形成原电池 | B. | 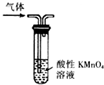 除去乙烯中混有的SO2 | ||
| C. | 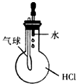 验证HCl气体在水中的溶解性 | D. | 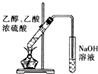 实验室制取乙酸乙酯 |
10. 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成如表实验设计表(表中不要留空格).
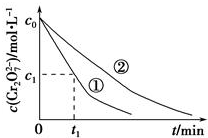
①和②溶液中的Cr2O72-浓度随时间变化关系如图所示.
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响(或溶液pH越小,反应速率越大);实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成下表中内容.[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定.]
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成如表实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水 体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响(或溶液pH越小,反应速率越大);实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成下表中内容.[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定.]
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
7.常温下,如图表示向10mLpH=3的A溶液中加水稀释到V1mL溶液pH的变化.下列说法中正确的是( )
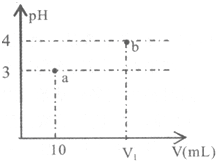

| A. | 若V1=100,则稀释前A的浓度一定是0.001mol/L | |
| B. | 若A为NH4Cl和HCl的混合溶液,则V1一定大于100 | |
| C. | a点水的电离程度一定小于b点 | |
| D. | 若A为NH4Cl和NH3•H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) |