题目内容
16.要证明某溶液中不含Fe3+而可能含有Fe2+进行如下实验操作时,最佳顺序为( )①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量NH4SCN溶液.
| A. | ①③ | B. | ③② | C. | ③① | D. | ①②③ |
分析 实验目的是证明某溶液中不含Fe3+而可能含有Fe2+,需要先用硫氰化钾溶液排除铁离子,然后加入氧化剂氯水证明原溶液中含有亚铁离子,据此进行解答.
解答 解:因为SCN-与Fe3+作用使溶液显红色,与Fe2+作用无此现象,可以先滴加NH4SCN溶液,原溶液不显红色,说明原溶液不含有Fe3+,然后滴加氯水后显红色,说明滴加氯水后溶液中含有Fe3+,则证明原溶液含有Fe2+,所以最佳顺序为③①,
故选C.
点评 本题考查了铁离子、亚铁离子的检验方法,题目难度不大,明确常见离子的检验方法为解答关键,注意掌握检验亚铁离子、铁离子的检验方法,试题培养了学生的化学实验能力.

练习册系列答案
相关题目
6.已知:Na2S2O3+H2SO4=Na2SO4+SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如下系列实验::
(1)该实验①、②可探究温度对反应速率的影响,因此V1=V2=10.0,V3=0;
(2)若V4=10.0,V5=6.0,则实验①、③可探究浓度对反应速率的影响.
| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)若V4=10.0,V5=6.0,则实验①、③可探究浓度对反应速率的影响.
7.常温下,如图表示向10mLpH=3的A溶液中加水稀释到V1mL溶液pH的变化.下列说法中正确的是( )
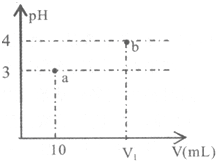

| A. | 若V1=100,则稀释前A的浓度一定是0.001mol/L | |
| B. | 若A为NH4Cl和HCl的混合溶液,则V1一定大于100 | |
| C. | a点水的电离程度一定小于b点 | |
| D. | 若A为NH4Cl和NH3•H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
4.在一定温度下的某容积不变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)?CO(g)+H2(g),下列叙述中不能认定上述可逆反应在一定条件下已达到化学平衡状态的是( )
| A. | v正(CO)=v逆(H2O) | |
| B. | 2 mol H-O键断裂的同时有1 mol H-H键形成 | |
| C. | 生成n mol CO的同时生成n mol H2O(g) | |
| D. | 体系的压强不再发生变化 |
11.已知Cr(OH)3在碱性较强的溶液中将生成[Cr(OH)4]-,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍.因此,必须对含铬的废水进行处理,可采用以下两种方法.
【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:

有关离子完全沉淀的pH如下表:
(1)写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式Cr2O72-+6Fe2++14H+═2 Cr3++6Fe3++7H2O.
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:C(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
【方法一】还原法 在酸性介质中用FeSO4等将+6价铬还原成+3价铬.具体流程如下:

有关离子完全沉淀的pH如下表:
| 有关离子 | Fe2+ | Fe3+ | Cr3+ |
| 完全沉淀为对应氢氧化物的pH | 9.0 | 3.2 | 5.6 |
(2)还原+6价铬还可选用以下的BD试剂(填序号).
A.明矾 B.铁屑 C.生石灰 D.亚硫酸氢钠
(3)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀.则在操作②中可用于调节溶液pH的试剂为:C(填序号);
A.Na2O2 B.Ba(OH)2 C.Ca(OH)2
此时调节溶液的pH范围在B(填序号)最佳.
A.3~4 B.6~8 C.10~11 D.12~14
【方法二】电解法 将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解.阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去.
(4)写出阴极的电极反应式2H++2e-═H2↑或2H2O+2e-═H2↑+2OH-.
(5)电解法中加入氯化钠的作用是:增强溶液导电性.
1.下列说法正确的是( )
| A. | N2(g)+3H2(g)?2NH3(g)△H<0其他条件不变时升高温度,反应速率v(H2)和H2的转化率均增大 | |
| B. | 同时改变两个变量来研究反应速率的变化,能更快得出有关规律 | |
| C. | 合成氨反应是放热反应,所以工业合成氨时温度越低越好 | |
| D. | 恒温、恒容的条件下对于N2(g)+3H2(g)?2NH3(g)△H<0的反应,混合气体的平均相对分子质量不变可以作为其达到化学平衡状态的标志 |
5.设NA表示阿伏加德罗常数的数值,则下列说法中正确的是( )
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 1mol氯气跟足量的NaOH溶液完全反应,转移的电子数为2NA | |
| C. | 1mol Na2O含离子数为3NA | |
| D. | 0.1mol/L MgCl2溶液中含氯离子数为0.2NA |