题目内容
15.海带中含有丰富的碘.为了从海带中提取碘,某研究性学习小组设计并进行了以下实验: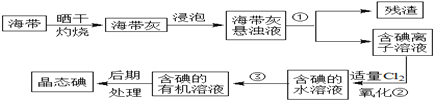
(1)步骤①的实验操作名称是过滤;
(2)现有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器、物品.完成该实验尚缺少的玻璃仪器是漏斗和分液漏斗;
(3)步骤③中能选用CCl4从碘水中萃取碘的原因是(双选)A、E;
A.CCl4与水不互溶 B.CCl4可与I2发生取代反应 C.CCl4的密度比水大 D.CCl4不易燃烧,可作灭火剂 E.碘在CCl4中的溶解度比在水中大很多
(4)步骤②中反应的离子方程式为Cl2+2I-=2Cl-+I2;
(5)请设计一种简单的实验方法,检验提取碘后的水溶液中是否还含有单质碘:取少量待测液注入试管中,滴加淀粉溶液,若溶液变蓝色,说明水溶液中存在I2,否则水溶液中无I2.
分析 海带晒干灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质,溶于水,浸泡过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用四氯化碳萃取得到含碘的有机溶液,经蒸馏可得到碘.
(1)分离固体和液体用过滤;
(2)海带中提取碘过程中要用到灼烧,过滤,分液,依据操作过程选择仪器;
(3)根据萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多分析;
(4)氯气可将含碘离子的溶液氧化为碘单质;
(5)根据碘单质的特性来检验,淀粉遇到单质碘变蓝色;
解答 解:(1)分离固体和液体,则实验操作名称为过滤,
故答案为:过滤;
(2)过滤要用到漏斗(主要材质玻璃)、烧杯、玻璃棒、铁架台(含铁圈)、滤纸;分液需要用到分液漏斗,完成该实验尚缺少的玻璃仪器是:漏斗、分液漏斗,
故答案为:漏斗、分液漏斗;
(3)根据萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,步骤③中能选用CCl4从碘水中萃取碘的原因是:
A.CCl4与水不互溶,符合萃取分液溶剂要求,故A正确;
B.CCl4不可与I2发生取代反应,故B错误;
C.CCl4的密度比水大不是萃取的原因,故C错误;
D.CCl4不易燃烧,可作灭火剂,与萃取分液实验操作无关,故D错误;
E.碘在CCl4中的溶解度比在水中大很多,加入四氯化碳碘单质会进入四氯化碳层,分液后蒸馏得到碘单质,故E正确;
故答案为:AE;
(4)氯气可将含碘离子的溶液氧化为碘单质,分液的离子方程式为:Cl2+2I-═I2+2Cl-,
故答案为:Cl2+2I-═I2+2Cl-;
(5)根据淀粉遇碘变蓝色检验碘单质的存在,实验操作为取少量提取碘后的水溶液于试管中,加入几滴淀粉试液,观察是否出现蓝色,如果变蓝,说明含有单质碘,否则水溶液中无I2,
故答案为:取少量待测液注入试管中,滴加淀粉溶液,若溶液变蓝色,说明水溶液中存在I2,否则水溶液中无I2.
点评 本题考查灼烧的实验,物质的分离方法,碘单质的检验,题目难度中等,考查学生解决实际问题的能力.

| 实验序号 | 反应温度/℃ | Na2S2O3溶液 | 稀H2SO4 | H2O | ||
| V/mL | c/(mol/L) | V/mL | c/(mol/L) | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)若V4=10.0,V5=6.0,则实验①、③可探究浓度对反应速率的影响.
 某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:
某酸性工业废水中含有K2Cr2O7.光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,草酸被氧化成CO2某课题组研究发现,少量铁明矾[Al2Fe(SO4)4•24H2O]即可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)在25℃下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,做对比实验,完成如表实验设计表(表中不要留空格).
| 实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水 体积/mL |
| ① | 4 | 60 | 10 | 30 |
| ② | 5 | 60 | 10 | 30 |
| ③ | 5 | 60 | 20 |
(2)上述反应中参加反应的Cr2O72-与草酸的物质的量之比为1:3.
(3)实验①和②的结果表明溶液pH对该反应的速率有影响(或溶液pH越小,反应速率越大);实验①中0~t1时间段反应速率v(Cr3+)=$\frac{2({c}_{0}-{c}_{1})}{{t}_{1}}$mol•L-1•min-1(用代数式表示).
(4)该课题组对铁明矾[Al2Fe(SO4)4•24H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;
假设二:Al3+起催化作用;
假设三:SO42-起催化作用;
(5)请你设计实验验证上述假设一,完成下表中内容.[除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4•Al2(SO4)3•24H2O、Al2(SO4)3等.溶液中Cr2O72-的浓度可用仪器测定.]
| 实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
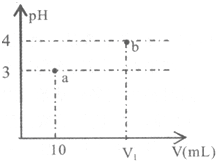
| A. | 若V1=100,则稀释前A的浓度一定是0.001mol/L | |
| B. | 若A为NH4Cl和HCl的混合溶液,则V1一定大于100 | |
| C. | a点水的电离程度一定小于b点 | |
| D. | 若A为NH4Cl和NH3•H2O的混合溶液,则溶液中c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| A. | v正(CO)=v逆(H2O) | |
| B. | 2 mol H-O键断裂的同时有1 mol H-H键形成 | |
| C. | 生成n mol CO的同时生成n mol H2O(g) | |
| D. | 体系的压强不再发生变化 |
| A. | 常温常压下,11.2LCH4中含有的氢原子数为2NA | |
| B. | 1mol氯气跟足量的NaOH溶液完全反应,转移的电子数为2NA | |
| C. | 1mol Na2O含离子数为3NA | |
| D. | 0.1mol/L MgCl2溶液中含氯离子数为0.2NA |

 .
.