题目内容
14.只需加入一种试剂就可以把Na2SiO3、Na2CO3、MgCl2、Ba(HCO3)2四种无色溶液鉴别出来,这种试剂是( )| A. | 盐酸 | B. | 硫酸 | C. | 石灰水 | D. | 硝酸银溶液 |
分析 Na2SiO3、Na2CO3、MgCl2、Ba(HCO3)2四种无色溶液分别与硫酸反应的现象为:白色沉淀、无色气体、无现象、白色沉淀和气体,以此来解答.
解答 解:A.盐酸不能鉴别Na2CO3、Ba(HCO3)2,故A不选;
B.Na2SiO3、Na2CO3、MgCl2、Ba(HCO3)2四种无色溶液分别与硫酸反应的现象为:白色沉淀、无色气体、无现象、白色沉淀和气体,现象不同可鉴别,故B选;
C.石灰水不能鉴别Na2CO3、MgCl2、Ba(HCO3)2,故C不选;
D.硝酸银不能鉴别Na2SiO3、Na2CO3、MgCl2,故D不选;
故选B.
点评 本题考查物质的鉴别和检验,为高考常见题型,侧重于学生的分析、实验能力的考查,把握物质的性质、发生的反应和现象为解答的关键,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
5.元素X的原子,其M层与K层电子数相同;元素Y的原子,其M层上有7个电子.X和Y所形成的稳定化合物的相对分子质量为( )
| A. | 100 | B. | 95 | C. | 88 | D. | 80 |
2.在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO2+2H2S═3S+2H2O | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | NaOH+HCl═NaCl+H2O |
9.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;化学性质最不活泼的元素是Ar.
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
6.物质的量浓度相同的下列溶液中,c(NH4+)最大的是( )
| A. | NH4Cl | B. | (NH4)2SO4 | C. | NH4HSO4 | D. | NH4HCO3 |
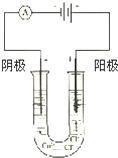 按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.
按如图所示装置连接好仪器在U形管中加入饱和氯化铜溶液,用石墨棒作电极,接通电源,电解数分钟后,观察现象.