题目内容
18.在2KMnO4+16HCl═2KCl+2MnCl2+5Cl2↑+8H2O反应中氧化剂与还原剂物质的量之比为( )| A. | 1:8 | B. | 8:1 | C. | 1:5 | D. | 5:1 |
分析 2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,通过化合价升降判断,Mn元素由+7价降低到+2价,Cl元素的化合价由-1价升高到0,高锰酸钾得电子是氧化剂,利用电子的转移与结合方程式进行计算.
解答 解:反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中,Mn元素由+7价降低到+2价,Cl元素的化合价由-1价升高到0,2mol高锰酸钾在反应中得电子,为氧化剂,10molHCl(另外的6molHCl表现酸性)失电子是还原剂,所以氧化剂与还原剂的物质的量之比是2:10=1:5,
故选C.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,为高频考点,题目难度中等,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质.

练习册系列答案
相关题目
8.用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )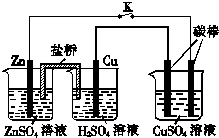

| A. | 铜棒为正极,其电极反应式为2H++2e-=H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为6.5 g | |
| D. | 导线中通过电子的物质的量为0.1 mol |
9.下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在这些元素中,金属性最强的元素是K,最活泼的非金属元素是F;化学性质最不活泼的元素是Ar.
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
(2)元素的最高价氧化物对应的水化物中酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3
(3)在③~⑦元素中,原子半径最大的是Na;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明(写出反应的化学方程式):2NaBr+Cl2=2NaCl+Br2.与⑩元素同主族下一周期元素的一种化合物是食用盐中必须加入的,此化合物的化学式KIO3.
6.物质的量浓度相同的下列溶液中,c(NH4+)最大的是( )
| A. | NH4Cl | B. | (NH4)2SO4 | C. | NH4HSO4 | D. | NH4HCO3 |
13.在由水电离产生的c(H+)=1×10-14mol/L的无色溶液中,一定可以大量共存的离子组是( )
| A. | K+、Na+、HCO3-、SO42- | B. | K+、Cu2+、Cl-、NO3- | ||
| C. | NH4+、Al3+、Br-、SO42- | D. | Na+、Ba2+、Cl-、NO3- |
10.砹(At)是卤素中核电荷数最大的元素,推测砹或砹的化合物性质的叙述中正确的是( )
| A. | 砹为有色固体 | |
| B. | HAt 很稳定 | |
| C. | AgAt易溶于水 | |
| D. | 砹单质的熔沸点比碘单质的熔沸点低 |
7.下列属于吸热反应的是( )
| A. | 铝与盐酸反应 | B. | Ba(OH)2?8H2O和NH4Cl固体反应 | ||
| C. | 盐酸和氢氧化钠的中和反应 | D. | 氢气的燃烧反应 |
8.绿矾(FeSO4•7H2O)是治疗缺铁性贫血药品的重要成分,下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
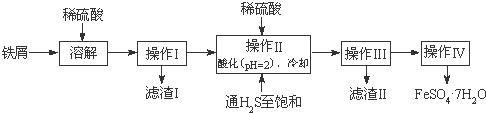
查询资料,得25℃时有关物质的数据如下表:
(1)操作II中,先通入硫化氢至饱和的目的是使Fe3+还原成Fe2+,并使Sn2+离子完全沉淀,后加入硫酸酸化至pH=2的作用是防止Fe2+离子生成沉淀.
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是部分Fe2+被空气中O2氧化;
④该绿矶产品中绿矾的质量分数为97.54%.

查询资料,得25℃时有关物质的数据如下表:
| 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 | |
| pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(2)操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:
①除去晶体表面附着的硫酸等杂质;
②降低洗涤过程中FeSO4•7H2O的损耗.
(3)工业上常用氧化还原滴定法测定绿矾产品中Fe2+含量,测定步骤如下:
a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL.
①已知酸性KMnO4被FeSO4还原时生成Mn2+.写出该测定过程的离子反应方程式:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;
②判断此滴定实验达到终点的方法是滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色;
③若实验操作无失误,测得上述样品中FeSO4•7H2O的含量仍偏低,则可能的原因是部分Fe2+被空气中O2氧化;
④该绿矶产品中绿矾的质量分数为97.54%.