题目内容
13.下列叙述中正确的是( )| A. | 在元素周期表中除短周期外,其他周期均有18种元素 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 副族元素中没有非金属元素 | |
| D. | 碱金属元素是指IA族的所有元素 |
分析 A.第六周期含有32种元素;
B.分子中所有原子的质子数与核外电子数相等;
C.副族又称为过渡金属元素;
D.碱金属元素是指IA族H以外的元素.
解答 解:A.第六周期含有镧系元素,共有32种元素,故A正确;
B.分子中所有原子的质子数与核外电子数相等,故B错误;
C.副族又称为过渡金属元素,都是金属元素,故C正确;
D.碱金属元素是指IA族H以外的元素,包括Li、Na、K、Rb、Cs、Fr等,故D错误.
故选C.
点评 本题考查长式元素周期表的结构,要求学生对元素周期表的组成特点要熟悉,周期表中周期与周期之间,族与族之间含有较多规律,在学习中要善于抓住这些规律会起到事半功倍的效果.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
3.某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)

反应原理:

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
(1)仪器A的名称是分液漏斗.
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:混酸未冷却加入三颈瓶(或水浴温度过高)导致反应温度过高而产生大量副产物或冷凝效果不佳导致浓硝酸、甲苯等反应物挥发而降低一硝基甲苯产率.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合液$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物\stackrel{操作2}{→}\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无机混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).

反应原理:

实验步骤:①浓硫酸与浓硝酸按体积比1:3配制混合溶液(即混酸)共40mL;
②在三颈瓶中加入13g甲苯(易挥发),按图所示装好药品和其他仪器;
③向三颈瓶中加入混酸;
④控制温度约为50℃-55℃,反应大约10min,三颈瓶底有大量淡黄色油状液体出现;
⑤分离出一硝基甲苯,经提纯最终得到对硝基甲苯和邻硝基甲苯共15g.
相关物质的性质如下:
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |
(2)配制混酸的方法是量取30mL浓硝酸倒入烧杯中,再量取10mL浓硫酸沿烧杯内壁(或玻璃棒)缓缓注入烧杯并不断搅拌.
(3)若实验后在三颈瓶中收集的产物较少,可能的原因是:混酸未冷却加入三颈瓶(或水浴温度过高)导致反应温度过高而产生大量副产物或冷凝效果不佳导致浓硝酸、甲苯等反应物挥发而降低一硝基甲苯产率.
(4)本实验采用水浴加热,水浴加热的优点是受热均匀、易于控制温度.
(5)分离反应后产物的方案如下:
混合液$\stackrel{操作1}{→}$$\left\{\begin{array}{l}{有机混合物\stackrel{操作2}{→}\left\{\begin{array}{l}{甲苯}\\{邻对硝基甲苯}\end{array}\right.}\\{无机混合物}\end{array}\right.$
操作1的名称是分液,操作2中不需要用到下列仪器中的de.(填序号)
a.冷凝管
b.酒精灯
c.温度计
d.分液漏斗
e.蒸发皿
(6)本实验中邻、对硝基甲苯的产率为77.5%(结果保留小数点后一位数字).
4.以下有关元素性质的说法不正确的是( )
| A. | 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4原子半径最大的是① | |
| B. | 具有下列最外层电子排布式的原子中,①3s23p1②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③ | |
| C. | ①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④ | |
| D. | 某元素气态基态原子的逐级电离能分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X3+ |
8.用如图所示的装置进行实验,反应一段时间后断开K,向烧杯中加入0.1mol CuO后CuSO4溶液恰好恢复到反应前的浓度和pH.下列说法中不正确的是( )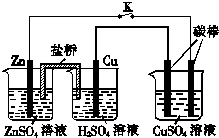

| A. | 铜棒为正极,其电极反应式为2H++2e-=H2↑ | |
| B. | 烧杯右侧碳棒为阴极,其电极表面有红色物质析出 | |
| C. | 反应中消耗锌的质量为6.5 g | |
| D. | 导线中通过电子的物质的量为0.1 mol |
18.科学兴趣小组为了研究酸雨的成分及成因,对取得的酸雨样品进行了pH的测定,随时间推移,得到了如下实验数据.
(1)雨水样品放置时,pH变化的主要原因为:2H2SO3+O2=2H2SO4(用化学方程式表示),由此可以得出酸雨形成过程可能是(用化学方程式表示)SO2+H2O=H2SO3.
(2)下列各选项是酸雨给人类造成的危害,其中不正确的是C.
A.腐蚀建筑物、雕塑等 B.污染水源 C.改良碱性土壤 D.损害庄稼
(3)现有以下几种措施:
①对燃烧煤时产生的尾气进行除硫处理,
②少用原煤作燃料,
③燃烧时鼓入足量空气,
④开发清洁能源.
其中能减少酸雨产生的措施是C.
A.①②③B.②③④C.①②④D.①③④
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
(2)下列各选项是酸雨给人类造成的危害,其中不正确的是C.
A.腐蚀建筑物、雕塑等 B.污染水源 C.改良碱性土壤 D.损害庄稼
(3)现有以下几种措施:
①对燃烧煤时产生的尾气进行除硫处理,
②少用原煤作燃料,
③燃烧时鼓入足量空气,
④开发清洁能源.
其中能减少酸雨产生的措施是C.
A.①②③B.②③④C.①②④D.①③④
5.元素X的原子,其M层与K层电子数相同;元素Y的原子,其M层上有7个电子.X和Y所形成的稳定化合物的相对分子质量为( )
| A. | 100 | B. | 95 | C. | 88 | D. | 80 |
2.在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | SO2+2H2S═3S+2H2O | ||
| C. | Mg3N2+6H2O═3Mg(OH)2↓+2NH3↑ | D. | NaOH+HCl═NaCl+H2O |