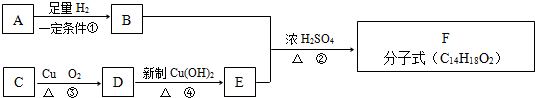
题目内容
实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的主要实验流程如图.
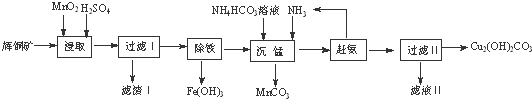
(1)滤渣Ⅰ的成分为MnO2、单质S和 (写化学式);硫酸浸取时,Cu2S被MnO2氧化的化学方程式为 .
(2)浸取时,Fe2O3溶于硫酸的离子方程式为 ;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是 .
(3)“赶氨”时,最适宜的操作方法是 .
(4)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式).

(1)滤渣Ⅰ的成分为MnO2、单质S和
(2)浸取时,Fe2O3溶于硫酸的离子方程式为
(3)“赶氨”时,最适宜的操作方法是
(4)滤液Ⅱ经蒸发结晶得到的盐主要是
考点:物质分离和提纯的方法和基本操作综合应用,制备实验方案的设计
专题:实验设计题
分析:辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜;
(1)分析流程结合物质性质可知二氧化硅不溶于稀硫酸溶液,硫化亚铜在酸溶液在被二氧化锰氧化生成硫酸铜,硫单质和硫酸锰;
(2)浸取时氧化铜溶液稀硫酸生成硫酸铁和水,若先除铁再浸取,浸取速率明显变慢,Fe2O3在浸取时起媒介作用,Fe3+可催化Cu2S被MnO2氧化;
(3)“赶氨”时,最适宜的操作方法是减小氨气溶解度,加热驱赶;
(4)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体.
(1)分析流程结合物质性质可知二氧化硅不溶于稀硫酸溶液,硫化亚铜在酸溶液在被二氧化锰氧化生成硫酸铜,硫单质和硫酸锰;
(2)浸取时氧化铜溶液稀硫酸生成硫酸铁和水,若先除铁再浸取,浸取速率明显变慢,Fe2O3在浸取时起媒介作用,Fe3+可催化Cu2S被MnO2氧化;
(3)“赶氨”时,最适宜的操作方法是减小氨气溶解度,加热驱赶;
(4)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体.
解答:
解:辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜;
(1)分析流程结合物质性质可知二氧化硅不溶于稀硫酸溶液,硫化亚铜在酸溶液在被二氧化锰氧化生成硫酸铜,硫单质和硫酸锰,反应的化学方程式为:2MnO2+Cu2S+4H2SO4=2MnSO4+2CuSO4+S+4H2O,故答案为:SiO2,2MnO2+Cu2S+4H2SO4=2MnSO4+2CuSO4+S+4H2O;
(2)浸取时氧化铜溶液稀硫酸生成硫酸铁和水,浸取时,Fe2O3溶于硫酸的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,若先除铁再浸取,浸取速率明显变慢,Fe2O3在浸取时起媒介作用,Fe3+可催化Cu2S被MnO2氧化,
故答案为:Fe2O3+6H+=2Fe3++3H2O;Fe3+可催化Cu2S被MnO2氧化;
(3))“赶氨”时,最适宜的操作方法是减小氨气溶解度,氨气是易挥发的气体,加热驱赶,故答案为:将溶液加热;
(4)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,故答案为:(NH4)2SO4.
(1)分析流程结合物质性质可知二氧化硅不溶于稀硫酸溶液,硫化亚铜在酸溶液在被二氧化锰氧化生成硫酸铜,硫单质和硫酸锰,反应的化学方程式为:2MnO2+Cu2S+4H2SO4=2MnSO4+2CuSO4+S+4H2O,故答案为:SiO2,2MnO2+Cu2S+4H2SO4=2MnSO4+2CuSO4+S+4H2O;
(2)浸取时氧化铜溶液稀硫酸生成硫酸铁和水,浸取时,Fe2O3溶于硫酸的离子方程式为:Fe2O3+6H+=2Fe3++3H2O,若先除铁再浸取,浸取速率明显变慢,Fe2O3在浸取时起媒介作用,Fe3+可催化Cu2S被MnO2氧化,
故答案为:Fe2O3+6H+=2Fe3++3H2O;Fe3+可催化Cu2S被MnO2氧化;
(3))“赶氨”时,最适宜的操作方法是减小氨气溶解度,氨气是易挥发的气体,加热驱赶,故答案为:将溶液加热;
(4)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,故答案为:(NH4)2SO4.
点评:本题考查了物质分离提纯的方法和流程分析应用,主要是物质性质的理解,掌握基础是关键,题目难度中等.

练习册系列答案
 名题金卷系列答案
名题金卷系列答案
相关题目
设阿伏加德罗常数为NA,下列说法正确的是( )
| A、2 L 0.5 mol?L-1硫酸钾溶液中阴离子所带电荷数为NA |
| B、常温常压下,14g氮气中含有 NA个原子 |
| C、1mol/LNaCl溶液中含有NA个氯离子 |
| D、等质量的丙烯和乙烯气体中氢原子的个数均为6NA |
下列物质都能有Na反应放出H2,其产生的H2的速率排列顺序正确的是( )
①C2H5OH;②CH3COOH;③NaCl(aq)
①C2H5OH;②CH3COOH;③NaCl(aq)
| A、①>②>③ |
| B、②>①>③ |
| C、③>①>② |
| D、②>③>① |
下列有关说法正确的是( )
| A、在同温同压下,相同体积的任何气体含有相同数目的原子 |
| B、氧化还原反应的判断依据是元素化合价是否有变化 |
| C、能导电的物质一定是电解质 |
| D、金属氧化物不一定是碱性氧化物 |