题目内容
5.用20g烧碱配制成500mL溶液.(1)所得溶液的物质的量浓度为多少?(写出计算过程,下同)
(2)从中取出1mL,将其用水稀释到100mL,所得溶液中溶质的物质的量浓度为多少?
分析 (1)依据n=$\frac{m}{M}$计算氢氧化钠的物质的量,依据C=$\frac{n}{V}$计算溶液的物质的量浓度;
(2)依据溶液具有均一性,稀释过程中溶质的物质的量保持不变计算.
解答 解:(1)n=$\frac{m}{M}$=20g÷40g/mol=0.5 mol;c=$\frac{n}{V}$=0.5 mol÷0.5L=1mol/L;
答:所得溶液物质的量浓度为1mol/L;
(2)溶液具有均一性,从配好的溶液中取出1mL,则溶液浓度为1mol/L,设稀释前溶液浓度为C1,稀释后为C2,稀释前溶液体积为V1,稀释过为V2,依据溶液稀释规律C1V1=C2V2,得:C2=$\frac{{C}_{1}{V}_{1}}{{V}_{2}}$=1 mol/L×1mL÷100mL=0.01 mol/L,
答:稀释后溶液物质的量浓度为0.01mol/L.
点评 本题考查了有关物质的量浓度计算,熟悉以物质的量为核心的计算公式,明确溶液稀释规律是解题关键,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
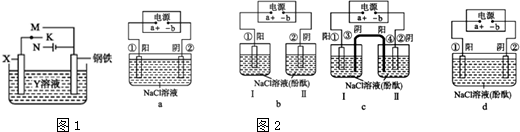
15.雾霾严重影响人们的生活与健康.某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl-.某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:
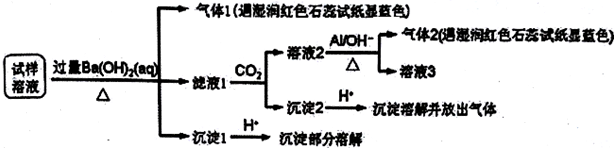
己知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3+8AlO2-,根据以上的实验操作与现象,该同学得出的结论不正确的是( )

己知:3NO3-+8Al+5OH-+2H2O$\stackrel{△}{→}$3NH3+8AlO2-,根据以上的实验操作与现象,该同学得出的结论不正确的是( )
| A. | 试样中肯定存在NH4+、Mg2+、SO42-和NO3- | |
| B. | 该雾霾中可能存在NaNO3、NH4Cl和MgSO4 | |
| C. | 试样中可能存在Na+、Cl- | |
| D. | 试样中一定不含Al3+ |
20.在密闭容器中发生反应H2(g)+I2(g)═2HI(g),0~5min内H2的浓度减少了0.50mol/L,则在这段时间内用H2表示的平均反应速率[mol/(L•min)]为( )
| A. | 0.01 | B. | 0.10 | C. | 0.04 | D. | 0.50 |
10.下列离子方程式正确的是( )
| A. | 纯碱溶液显碱性:CO32-+2H2O?H2CO3+2OH- | |
| B. | 醋酸溶液显酸性:CH3COOH+H2O?CH3COO-+H3O+ | |
| C. | 向碘化亚铁溶液中通入足量的溴水:2 Br2+2Fe2++2I-═4Br-+2Fe3++I2 | |
| D. | 向碳酸氢钙溶液中滴加过量的烧碱溶液:HCO3-+Ca2++2OH-═CaCO3↓+H2O |
17.为了防止废弃塑料带来的“白色污染”,下列做法不可取的是( )
| A. | 回收各种废弃塑料 | B. | 将用过的塑料袋立即焚烧 | ||
| C. | 使用可降解塑料 | D. | 用布购物袋替代一次性塑料购物袋 |
4.已知A、B、C、D、E是短周期主族元素,原子序数依次增大.其中A、E的单质在常温下呈气态,B的原子最外层电子数是其电子层数的2倍,C在同周期主族元素中原子半径最大,D的周期序数与主族序数相同.下列说法正确的是( )
| A. | B位于元素周期表中第二周期第ⅥA族 | |
| B. | 工业上可以用电解CE溶液的方法同时获得C、E单质 | |
| C. | C、D的最高价氧化物对应的水化物之间能发生化学反应 | |
| D. | 化合物AE与CE具有相同类型的化学键 |
5.下列化学用语中正确的是( )
| A. | 乙烯的结构简式:CH2CH2 | B. | 羟基的电子式: | ||
| C. | 1-丁烯的键线式: | D. | 乙醇的分子式:CH3CH2OH |