题目内容
17.为了防止废弃塑料带来的“白色污染”,下列做法不可取的是( )| A. | 回收各种废弃塑料 | B. | 将用过的塑料袋立即焚烧 | ||
| C. | 使用可降解塑料 | D. | 用布购物袋替代一次性塑料购物袋 |
分析 白色污染是指用聚苯乙烯、聚丙烯、聚氯乙烯等高分子化合物制成的各类生活塑料制品使用后被弃置成为固体废物,要解决白色污染,要尽可能减少使用塑料品,回收废旧塑料,研制开发可降解塑料,不能焚烧,这样会造成二次污染,据此解答.
解答 解:A.回收利用各种废弃塑料,可以减少废塑料的丢弃,有利于减少白色污染,故A正确;
B.焚烧塑料产生烟雾和毒气,对环境造成二次污染,故B错误;
C.使用可降解塑料可以减少难降解塑料的使用,能够减少白色污染,故C正确;
D.用布袋代替塑料袋,因为布袋可降解,可以减少难降解塑料的使用,可以减少白色污染,故D正确;
故选:B.
点评 本题考查白色污染和防治,要明确白色污染主要指聚乙烯等塑料制品引起的污染,熟悉减少白色污染的方法和措施,有利于学生养成环境保护意识.

练习册系列答案
相关题目
8.常温下,体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )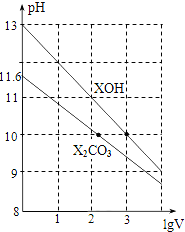

| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
2.(Ⅰ)下表是不同温度下水的离子积数据:
试回答以下问题:
(1)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1;
(2)在t2℃下,将amol•L-1CH3COOH溶液与bmol•L-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=$\frac{b×1{0}^{-6}}{a-b}$(用a、b表示);
(1I)已知:25℃下,下列反应;
Ag+(aq)+2NH3(aq)?Ag2(NH3)2+(aq)△H=akJ•mol-1 k=c
2Ag+(aq)+2OH-(aq)?Ag2O(s)+H2O(I)△H=blJ•mol-1 k=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:Ag2O(s)+H2O(l)+4NH3(aq)?2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJ?mol-1;计算25℃下,该反应的平衡常数(用c,d表示)k=$\frac{{c}^{2}}{d}$.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | 1×10-13 | 1×10-12 |
(1)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1;
(2)在t2℃下,将amol•L-1CH3COOH溶液与bmol•L-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=$\frac{b×1{0}^{-6}}{a-b}$(用a、b表示);
(1I)已知:25℃下,下列反应;
Ag+(aq)+2NH3(aq)?Ag2(NH3)2+(aq)△H=akJ•mol-1 k=c
2Ag+(aq)+2OH-(aq)?Ag2O(s)+H2O(I)△H=blJ•mol-1 k=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:Ag2O(s)+H2O(l)+4NH3(aq)?2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJ?mol-1;计算25℃下,该反应的平衡常数(用c,d表示)k=$\frac{{c}^{2}}{d}$.
17.下列化学用语的表述正确的是( )
| A. | Cl-的结构示意图: | B. | CCl4的电子式: | ||
| C. | 丙烯的结构简式:CH3CH2CH2 | D. | 次氯酸的结构式:H-Cl-O |