题目内容
20.在密闭容器中发生反应H2(g)+I2(g)═2HI(g),0~5min内H2的浓度减少了0.50mol/L,则在这段时间内用H2表示的平均反应速率[mol/(L•min)]为( )| A. | 0.01 | B. | 0.10 | C. | 0.04 | D. | 0.50 |
分析 反应速率是用单位时间内反应物浓度减小或生成物浓度增大表示,v=$\frac{△c}{△t}$计算得到.
解答 解:在密闭容器中发生反应H2(g)+I2(g)═2HI(g),0~5min内H2的浓度减少了0.50mol/L,则在这段时间内用H2表示的平均反应速率v=$\frac{0.50mol/L}{5min}$=0.10mol/(L•Lmin),
故选B.
点评 本题考查了化学反应速率概念的理解和计算应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
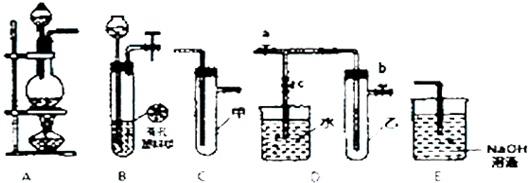
10.下列实验装置图及关于用途的描述,正确的是( )
| A. |  如图装置:用于制取并收集乙酸乙酯 | |
| B. |  如图装置:用于分离两种沸点不同的物质 | |
| C. |  如图装置:收集氨气时,从a口进气b口排气 | |
| D. |  如图装置:可用来快速制取氨气 |
8.常温下,体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )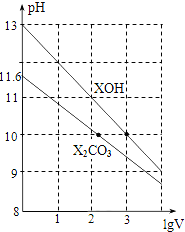

| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
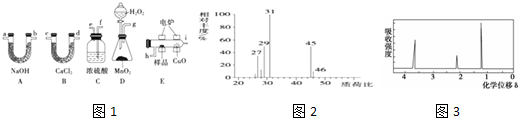
 某化学创新实验小组设计了如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.
某化学创新实验小组设计了如图示实验装置来制取溴苯并证明该反应为取代反应.已知:溴苯的熔点为?30.8℃,沸点156℃.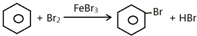 ;
;