题目内容
16.实验室可用甲酸制备甲酸铜.其方法是先用硫酸铜和碳酸氢钠作用制得碱式碳酸铜,然后再与甲酸制得四水甲酸铜[Cu(HCOO)2•4H2O]晶体.相关的化学方程式是:2CuSO4+4NaHCO3═Cu(OH)2•CuCO3↓+3CO2↑+2Na2SO4+H2O
Cu(OH)2•CuCO3+4HCOOH+5H2O═2Cu(HCOO)2•4H2O+CO2↑
实验步骤如下:

I.碱式碳酸铜的制备:
①步骤ⅰ是将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨,其目的是研细并混合均匀.
②步骤ⅱ是在搅拌下将固体混合物分多次缓慢加入热水中,反应温度控制在70℃~80℃,如果看到有黑色固体生成(填写实验现象),说明温度过高.
II.甲酸铜的制备:
将Cu(OH)2•CuCO3固体放入烧杯中,加入一定量热的蒸馏水,再逐滴加入甲酸至碱式碳酸铜恰好全部溶解,趁热过滤除去少量不溶性杂质.在通风橱中蒸发滤液至原体积的$\frac{1}{3}$时,冷却析出晶体,过滤,再用少量无水乙醇洗涤晶体2-3次,晾干,得到产品.
a、“趁热过滤”中,必须“趁热”的原因是防止甲酸铜晶体析出.
b、用乙醇洗涤晶体的目的是洗去晶体表面的水和其它杂质.
分析 碱式碳酸铜受热易分解,生成黑色的氧化铜.甲酸铜的溶解度随温度的升高而变大,需趁热过滤.根据“相似相溶原理”可知甲酸铜易溶于水,难溶于有机溶剂,
Ⅰ.①将一定量CuSO4•5H2O晶体和NaHCO3固体一起放到研钵中研磨会增大接触面积,加快反应速率;
②碱式碳酸铜受热易分解,生成黑色的氧化铜;
Ⅱ.a.甲酸铜的溶解度随温度的升高而变大;
b.根据“相似相溶原理”可知甲酸铜易溶于水,难溶于有机溶剂;
解答 解:碱式碳酸铜受热易分解,生成黑色的氧化铜.甲酸铜的溶解度随温度的升高而变大,需趁热过滤.根据“相似相溶原理”可知甲酸铜易溶于水,难溶于有机溶剂,
Ⅰ.①研磨的作用是把药品研细并混合均匀,
故答案为:研细并混合均匀;
②温度过高,Cu(OH)2•CuCO3会分解生成黑色的氧化铜,所以有黑色固体生成时说明温度过高,
故答案为:有黑色固体生成;
Ⅱ.a.甲酸铜的溶解度随温度的升高而变大,如果冷却,会有晶体析出,降低产率,因此需趁热过滤,
故答案为:防止甲酸铜晶体析出;
b.甲酸铜易溶于水,不能用蒸馏水洗涤,故需用乙醇进行洗涤,洗去晶体表面的液体杂质,
故答案为:洗去晶体表面的水和其它杂质.
点评 本题考查了制备方案的设计,题目难度不大,明确制备原理为解答关键,注意熟练掌握常见化学实验基本操作方法,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
6.下列叙述错误的是( )
| A. | 同系物之间在化学性质上相似 | |
| B. | 同系物之间的物理性质随分子里碳原子数的递增,呈规律性的变化 | |
| C. | 同系物不可能是同分异构体 | |
| D. | 分子组成相差一个或几个CH2原子团的物质互称为同系物 |
4.下列说法正确的是( )
| A. | $\stackrel{235}{92}$U和$\stackrel{238}{92}$U是中子数不同质子数相同的同种核素 | |
| B. | 质子数为53,中子数为78的碘原子:$\stackrel{131}{53}$I | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |
8.常温下,体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )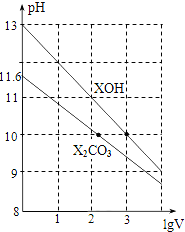

| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |

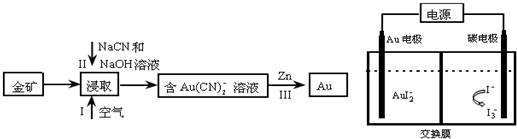
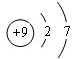 ,D离子的结构示意图:
,D离子的结构示意图: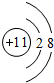 .
.