题目内容
13.(1)研究钢铁的防腐蚀措施意义重大.利用如图1装置,可以模拟铁的电化学防护,其中Y为NaCl.为减缓铁的腐蚀:①若X为碳棒,开关K应置于N(字母,下同)处,
②若X为锌,开关K应置于M处.
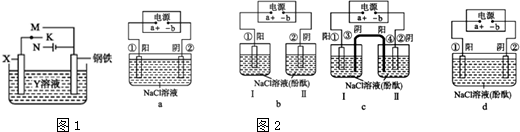
(2)在城市中地下常埋有纵横交错的管道和输电线路,地上还铺有地铁、城铁的铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道形成回路时,就会引起后者的腐蚀.为表示其原理,某班级的学生绘制了下列装置图2(假设电极材料均为铁,电解质均为NaCl溶液).
你认为其中能合理模拟金属管道的腐蚀原理的是acd;图c中的总反应方程式是Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2+H2↑.
分析 (1)①若K为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极;
②若K为锌,开关K置于a处,Zn为阳极被腐蚀,Fe为阴极被保护;
(2)根据原电池与电解池的形成条件分析,acd均形成闭合回路,正极相连的为阳极,负极相连的为阴极,b没能形成闭合回路.
解答 解:(1)①若X为碳棒,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe为电解池的阴极,故K连接N处,故答案为:N;
②若X为锌,开关K置于M处,Zn为负极被腐蚀,Fe为正极被保护,该防护法称为牺牲阳极的阴极保护法,故答案为:M;
(2)电极材料均为铁,电解质均为NaCl溶液,根据原电池与电解池的形成条件分析,acd均形成闭合回路,正极相连的为阳极,负极相连的为阴极,能够形成电解池,能模拟金属管道的腐蚀原理,b没能形成闭合回路,不能模拟,c中铁作阳极,失去电子发生氧化反应,水中的氢离子得电子发生还原反应,总反应方程式为Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2+H2↑,故答案为:acd;Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2+H2↑.
点评 本题考查了原电池和电解池原理,正极相连的为阳极,负极相连的为阴极,根据各个电极上发生的反应来分析解答,难度中等.

练习册系列答案
相关题目
3.将固体NH4I置于密闭容器中,在一定温度下发生下列反应:
①NH4I=NH3(g)+HI(g)
②2HI(g)=H2(g)+I2(g)
均为可逆反应,达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为( )
①NH4I=NH3(g)+HI(g)
②2HI(g)=H2(g)+I2(g)
均为可逆反应,达到平衡时,c(H2)=0.5mol/L,c(HI)=4mol/L,则此温度下反应①的平衡常数为( )
| A. | 12mol2•L-2 | B. | 16mol2•L-2. | C. | 20mol2•L-2 | D. | 25mol2•L-2 |
4.下列说法正确的是( )
| A. | $\stackrel{235}{92}$U和$\stackrel{238}{92}$U是中子数不同质子数相同的同种核素 | |
| B. | 质子数为53,中子数为78的碘原子:$\stackrel{131}{53}$I | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 通过化学变化可以实现16O与18O间的相互转化 |
8.常温下,体积为1ml、浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释至体积为V,pH随lgV的变化情况如图所示,下列叙述中正确的是( )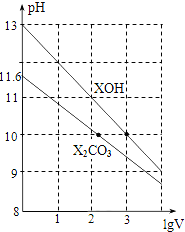

| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
18.下列选项中的物质,能用分液漏斗分离的是( )
| A. | 酒精和水 | B. | 四氯化碳和水 | C. | 乙酸和水 | D. | 汽油和苯 |
2.(Ⅰ)下表是不同温度下水的离子积数据:
试回答以下问题:
(1)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1;
(2)在t2℃下,将amol•L-1CH3COOH溶液与bmol•L-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=$\frac{b×1{0}^{-6}}{a-b}$(用a、b表示);
(1I)已知:25℃下,下列反应;
Ag+(aq)+2NH3(aq)?Ag2(NH3)2+(aq)△H=akJ•mol-1 k=c
2Ag+(aq)+2OH-(aq)?Ag2O(s)+H2O(I)△H=blJ•mol-1 k=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:Ag2O(s)+H2O(l)+4NH3(aq)?2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJ?mol-1;计算25℃下,该反应的平衡常数(用c,d表示)k=$\frac{{c}^{2}}{d}$.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | 1×10-13 | 1×10-12 |
(1)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol/L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1000:1;
(2)在t2℃下,将amol•L-1CH3COOH溶液与bmol•L-1NaOH溶液等体积混合反应后,溶液恰好呈中性,则该温度下CH3COOH的电离常数Ka=$\frac{b×1{0}^{-6}}{a-b}$(用a、b表示);
(1I)已知:25℃下,下列反应;
Ag+(aq)+2NH3(aq)?Ag2(NH3)2+(aq)△H=akJ•mol-1 k=c
2Ag+(aq)+2OH-(aq)?Ag2O(s)+H2O(I)△H=blJ•mol-1 k=d
(3)写出Ag2O溶于氨水(用NH3表示)生成银氨溶液[Ag(NH3)2+]的热化学方程式:Ag2O(s)+H2O(l)+4NH3(aq)?2Ag(NH3)2+(aq)+2OH-(aq)△H=(2a-b)kJ?mol-1;计算25℃下,该反应的平衡常数(用c,d表示)k=$\frac{{c}^{2}}{d}$.
13.下列说法正确的是( )
| A. | CH3Cl和CCl4分子的空间构型均为正四面体 | |
| B. | 1,2-二氯乙烯有顺反异构体,CH3CCl=CHBr不存在顺反异构现象 | |
| C. | CH3CH=CHC≡CCF3分子中6个C原子都在同一平面上 | |
| D. | 苯的对位二元取代物只有一种说明苯分子中碳碳键不是单、双键相间交替 |
 ,D离子的结构示意图:
,D离子的结构示意图: .
.