题目内容
17. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
分析 Ⅰ、根据公式m=nM=cVM来计算氢氧化钠的质量,但是没有245mL的容量瓶;
Ⅱ、(1)根据酸碱中和反应生成1mol液态水时放出57.3kJ的热量书写热化学方程式;
(2)①先判断温度差的有效性,然后求出温度差平均值;
②先根据Q=m•c•△T计算反应放出的热量,然后根据△H=-$\frac{Q}{n}$kJ/mol计算出反应热;
③a.实验成功关键在于保温,减少热量损失;
b.量取NaOH溶液的体积时视线要和凹液面最低处相平;
c.应尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高.
解答 解:Ⅰ、需要称量NaOH固体m=nM=cVM=0.5mol/L×0.5L×40g/mol=5.0g,故答案为:5.0;
Ⅱ、(1)已知稀强酸、稀强碱反应生成1mol液态水时放出57.3kJ的热量,稀硫酸和氢氧化钡钠稀溶液都是强酸和强碱的稀溶液,则反应的热化学方程式为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
故答案为:$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol;
(2)①4次温度差分别为:4.0℃,6.1℃,3.9℃,4.1℃,6.1℃舍去,温度差平均值=4.0℃,故答案为:4.0;
②50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的值为△T=4℃,则生成0.025mol水放出的热量为Q=m•c•△T=80g×4.18J/(g•℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热△H=-$\frac{1.3376kJ}{0.025mol}$=-53.5 kJ/mol,
故答案为:-53.5kJ/mol;
③a.实验装置保温、隔热效果必须好,否则影响实验结果,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,则大于57.3kJ/mol,故b错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,故c正确;
d.用温度计测定NaOH溶液起始温度后,要将温度计回零直再测定H2SO4溶液的温度,故d正确.
故答案为:acd.
点评 本题考查热化学方程式以及反应热的计算,题目难度大,注意理解中和热的概念、把握热化学方程式的书写方法,以及测定反应热的误差等问题.

 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案| A. | NaCN中碳元素的化合价为+4,是含碳的化合物,因此属于有机物 | |
| B. | 硝酸铵本身既具有氧化性又具有还原性,受热或撞击易发生爆炸 | |
| C. | 爆炸发生引发大火,可以用大量水灭火 | |
| D. | 为防止中毒,可用H2O2将NaCN还原为无毒物质 |
 利用下图装置测定中和热的实验步骤如下:
利用下图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度.
回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)倒入NaOH溶液的正确操作是C(从下列选出).
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使硫酸与NaOH溶液混合均匀的正确操作是D(从下列选出).
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃棒轻轻地搅动
(4)实验数据如下表:
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | 3.4℃ |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2CO3?2H++CO32- | D. | A12(SO4)3═2A13++3SO42- |

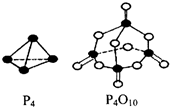 磷在氧气和氯气中都可以燃烧.
磷在氧气和氯气中都可以燃烧.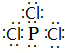 ;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).
;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).