题目内容
5. 磷在氧气和氯气中都可以燃烧.
磷在氧气和氯气中都可以燃烧.(1)磷在氧气中燃烧,可能生成两种固态氧化物(P2O3、P2O5).1mol的单质磷(P)在1mol的氧气中燃烧,至反应物耗尽,并放出x kJ的热量.计算确定反应产物的组成为P2O3、P2O5(写分子式).
己知单质磷在足量的氧气中燃烧的热化学方程式为P(s)+$\frac{5}{4}$O2(g)=$\frac{1}{2}$P2O5(s)△H=-y kJ•mol-1,则31g P与一定量的氧气反应完全生成P2O3的热化学方程式为P(s)+$\frac{3}{4}$O2(g)=$\frac{1}{2}$P2O3(s)△H=-(2X-Y)kJ/mol.
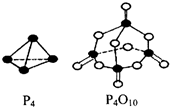
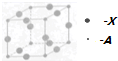
(2)白磷与氧气可发生如下反应:P4+5O2=P4O10.已知断裂下列化学键需要吸收能量分别为:P-P kJ•mol-1、P-O kJ•mol-1、P=O kJ•mol-1、O=O kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H为(6a+5d-4c-12b)kJ•mol-1.
(3)磷在氯气中燃烧可生成PCl5、PCl3,PCl3的电子式为
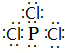 ;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).
;PCl3水解得到的亚磷酸(H3PO3)是一种二元弱酸,写出亚磷酸与足量NaOH反应的离子方程式H3PO3 +2OH-=HPO32-+2H2O;某温度下,0.1mol•L-1亚磷酸溶液c(H+)=2.5×10-2mol•L-1,除OH-之外其他离子浓度由大到小顺序是c(H+)>c(H2PO3-)>c(HPO32-).
分析 (1)根据P原子与O原子的比例关系确定燃烧产物的化学式,若为单一物质,根据质量守恒,该物质的质量等于磷与氧气质量之和,若为混合物,为P2O3、P2O5,令物质的量分别为xmol、ymol,利用P原子、O原子守恒列方程计算x、y的值,再根据m=nM计算各自质量;
1mol磷完全燃烧生成固态P2O5放出的热量为YkJ,计算1molP与O2反应生成固态P2O3的热量,注明物质的聚集状态与反应热书写热线方程式;
(2)反应热△H=反应物总键能-生成物总键能,注意每摩尔P4中含有6molP-P键;
(3)PCl3中P原子与Cl专家形成1对共用电子对;
亚磷酸(H3PO3)是一种二元弱酸,与足量NaOH反应生成Na2HPO3与水,H3PO3溶液中氢离子源于H3PO3、H2PO3-与水的电离,弱酸的二级电离远远小于一级电离.
解答 解:(1)P原子与O原子的数目之比为1mol:1mol×2=1:2,由于2:5<1:2<2:3,故反应产物为P2O3、P2O5,P2O5,令物质的量分别为xmol、ymol,则:
$\left\{\begin{array}{l}{2x+2y=1}\\{3x+5y=1×2}\end{array}\right.$
解得:x=0.25mol,y=0.25mol
1mol磷完全燃烧生成固态P2O5放出的热量为YkJ,反应中生成0.25molP2O5,需要磷0.5mol,故0.5mol磷燃烧生成生成固态P2O5放出的热量为0.5YkJ,反应中生成0.25molP2O3,需要磷0.5mol,所以0.5mol磷燃烧生成生成固态P2O3放出的热量为XkJ-0.5YkJ=(X-0.5Y)kJ,所以1molP与O2反应生成固态P2O3放出的热量为(X-0.5Y)kJ×$\frac{1mol}{0.5mol}$=(2X-Y)kJ,则31g P与一定量的氧气反应完全生成P2O3的热化学方程式为:P(s)+$\frac{3}{4}$O2(g)=$\frac{1}{2}$P2O3(s)△H=-(2X-Y)kJ/mol,
故答案为:P2O3、P2O5;P(s)+$\frac{3}{4}$O2(g)=$\frac{1}{2}$P2O3(s)△H=-(2X-Y)kJ/mol;
(2)各化学键键能为P-P a kJ•mol-1、P-O b kJ•mol-1、P=O c kJ•mol-1、O=O d kJ•mol-1.
反应热△H=反应物总键能-生成物总键能,所以反应P4+5O2=P4O10的反应热△H=6akJ•mol-1+5dkJ•mol-1-(4ckJ•mol-1+12bkJ•mol-1)=(6a+5d-4c-12b)kJ•mol-1,
故答案为:(6a+5d-4c-12b)kJ•mol-1;
(3)PCl3中P原子与Cl专家形成1对共用电子对,电子式为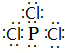 ,
,
亚磷酸(H3PO3)是一种二元弱酸,与足量NaOH反应生成Na2HPO3与水,反应离子方程式为:H3PO3 +2OH-=HPO32-+2H2O,
H3PO3溶液中氢离子源于H3PO3、H2PO3-与水的电离,弱酸的二级电离远远小于一级电离,故溶液中离子浓度:,
故答案为: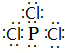 ;H3PO3 +2OH-=HPO32-+2H2O;c(H+)>c(H2PO3-)>c(HPO32-).
;H3PO3 +2OH-=HPO32-+2H2O;c(H+)>c(H2PO3-)>c(HPO32-).
点评 本题考查反应热的有关计算、热化学方程式的书写、弱电解质的电离、离子浓度大小比较、电子式等,属于拼合型题目,注意理解反应热与化学键键能的关系,难度中等.

 NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示,该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )
NO2、O2和熔融KNO3可制作燃料电池,其原理如图所示,该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用.下列说法正确的是( )| A. | O2在石墨Ⅱ附近发生氧化反应放电时,NO3-向石墨Ⅱ电极迁移 | |
| B. | 石墨Ⅱ极附近发生的反应:NO+O2+e-=NO3 | |
| C. | 电池的总反应式为:4NO2+O2=2N2O5 | |
| D. | 当外电路通过4mole-,负极上共产生2molN2O5 |
②CH3OH(g)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H=-192.9kJ•mol-1
下列说法正确的是( )
| A. | 由反应①②可计算出CH3OH的燃烧热 | |
| B. |  反应②中的能量变化如图所示 | |
| C. | 可推知2H2(g)+O2(g)=2H2O(g)△H=-483.8 kJ•mol-1 | |
| D. | 可推知CH3OH(l)+$\frac{1}{2}$O2(g)=CO2(g)+2H2(g)△H<-192.9 kJ•mol-1 |
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);.
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$不变
D.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(O{H^-})}}$减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
 A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族.
A、B、C、D、X五种元素的原子序数依次递增,A、B的常见单质是构成空气的主要成分;C 的基态原子核外电子占有7个轨道,但只有1个未成对电子;D的基态原子的M能层中只有1对成对电子和2个未成对电子;X元素处于第四周期ⅠB族. (1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.
(1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.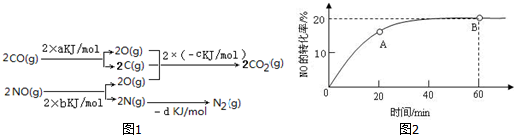
 ;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.
;该反应中,氧化产物是Cl2,还原产物是Cl2,氧化产物与还原产物的物质的量之比是5:1.