题目内容
2.下列物质在水中的电离方程式书写正确是( )| A. | NaHSO4═Na++HSO4- | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2CO3?2H++CO32- | D. | A12(SO4)3═2A13++3SO42- |
分析 强电解质在水溶液里完全电离生成阴阳离子,电离方程式写“=”,弱电解质在水溶液里部分电离,电离方程式写“?”,
A.硫酸氢根离子应该拆开;
B.碳酸氢钠电离出碳酸氢根离子和钠离子,碳酸氢根离子不能拆开;
C.碳酸的电离分步进行,电离方程式分步书写;
D.硫酸铝完全电离出铝离子和硫酸根离子.
解答 解:A.硫酸氢钠是强电解质,在水溶液里完全电离生成钠离子、氢离子和硫酸根离子,正确的电离方程式为:NaHSO4═Na++H++SO42-,故A错误;
B.碳酸氢根离子不能拆开,正确的电离方程式为:NaHCO3═Na++HCO3-,故B错误;
C.碳酸为二元弱酸,电离方程式应该分步书写,主要写出第一步电离即可,正确的电离方程式为:H2CO3?H++HCO3-,故C错误;
D.硫酸铝为强电解质,在溶液中完全电离,其电离方程式为:Al2(SO4)3═2A13++3SO42-,故D正确;
故选D.
点评 本题考查了电离方程式的书写,题目难度中等,明确电解质的强弱及电离方程式的书写规则是解本题关键,知道电解质电离出的阴阳离子分别是什么,注意一般情况下原子团不能拆开,为易错点,试题培养了学生的规范答题能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.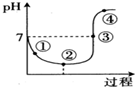 氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:
氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:
Cl2(g)?Cl2(aq) K1=10-1.2
Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
25℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,溶液pH变化的曲线如图所示.下列叙述正确的是( )
 氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:
氯气对水杀菌消毒体系中起杀菌作用的主要是HClO.25℃时氯气-氯水体系中存在以下平衡关系:Cl2(g)?Cl2(aq) K1=10-1.2
Cl2(aq)+H2O?HClO+H++Cl- K2=10-3.4
25℃时,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L-1的NaOH溶液,溶液pH变化的曲线如图所示.下列叙述正确的是( )
| A. | 用氯气对水杀菌消毒,夏季要比冬季好 | |
| B. | Cl2(g)+H2O?HClO+H++Cl- K=10-4.6 | |
| C. | 图中点③所示溶液中,c(Na+)=c(Cl-) | |
| D. | 图中点②所示溶液中水的电离程度大于点①所示溶液中水的电离程度 |
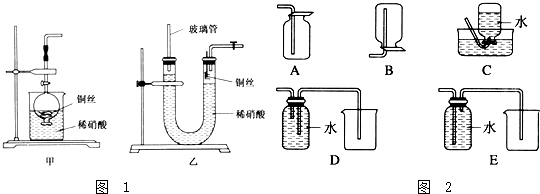
17. 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是acd(填字母)
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
14.按要求回答下列问题:
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);.
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$不变
D.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(O{H^-})}}$减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
①根据表中数据,将浓度均为0.01mol/L的下列四种酸的溶液分别稀释100倍,pH变化最小的是A.
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如表:
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,Cu2+(填离子符号)先沉淀,Ksp[Fe(OH)2]<Ksp[Mg(OH)2](填“>”、“=”或“<”)
(1)实验室常用NaOH溶液来进行洗气和提纯,当100mL3mol/L的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+);.
(2)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是CD.
A.溶液中导电粒子的数目减小
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(C{H_3}COOH)•c(O{H^-})}}$不变
D.溶液中$\frac{{c(C{H_3}CO{O^-})}}{{c(O{H^-})}}$减小
(3)①常温下将0.15mol/L稀硫酸V1mL与0.1mol/LNaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=1:1(溶液体积变化忽略不计).
②常温下若溶液由pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合而得,则下列说法正确的是
A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L
B.若V1=V2,反应后溶液pH一定等于7
C.若反应后溶液呈酸性,则V1一定大于V2
D.若反应后溶液呈碱性,则V1一定小于V2
(4)常温下,浓度均为0.1mol/L的下列五种溶液的pH值如表所示:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
A.HCN B.HClO C.H2CO3 D.CH3COOH
②根据以上数据,判断下列反应可以成立的是AB.
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
D.NaHCO3+HCN═NaCN+CO2+H2O
(5)几种离子开始沉淀时的pH如表:
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
12.下列物质中属于有机物的是( )
| A. |  | B. | NH4SCN | C. |  | D. |  |
 (1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.
(1)已知:2SO2(g)+O2═2SO3(g)△H=-196.6kJ•mol-1,2NO(g)+O2═2NO2(g)△H=-113.0kJ•mol-1.则反应NO2(g)+SO2(g)═SO3(g)+NO(g) 的△H=-41.8kJ/mol.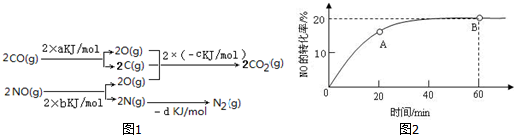
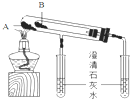 Na2CO3和NaHCO3是两种常见的钠盐.
Na2CO3和NaHCO3是两种常见的钠盐.