题目内容
7.为了测定含氰废水中CN-的含量,某化学小组利用如图装置进行实验.关闭活塞a,将100ml含氰废水与过量NaClO溶液置于装置B的圆底烧瓶中充分反应,打开活塞b,滴入稀硫酸溶液,然后关闭活塞b.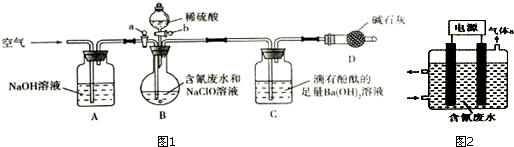
已知装置B中发生的主要反应为:CN-+ClO-=CNO-+Cl-
2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O
副反应为:Cl-+ClO-+2H+=Cl2↑+H2O
(1)装置D的作用是防止空气中的CO2和水蒸气进入C装置.
(2)反应过程中,装置C中的实验现象为有白色沉淀生成,溶液的红色逐渐褪色.
(3)待装置B中反应结束后,打开活塞a,缓慢通入一段时间的空气,目的是将反应产生的CO2全部排入C装置并被Ba(OH)2完全吸收.
(4)反应结束后,装置C中生成39.4mg沉淀,则废水中C(CN-)=0.002mol.L-1.
(5)对上述实验装置进行合理改进,可通过直接测量装置C反应前后的质量变化,测定废水中CN-
的含量.设计合理实验方案在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶.
仪器自选.供选择的试剂:浓硫酸、NaOH溶液、饱和食盐水、饱和NaHCO3溶液、CCl4.
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.
①气体a的化学式为H2.
②阳极的电极反应式为2CN-+4H2O-2e-=C2O42-+2NH4+.
分析 (1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定C装置的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去;
(3)反应结束后,缓缓通入空气,可将生成的二氧化碳全部被吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O,结合定量关系计算;
(5)通过直接测量装置C反应前后的质量变化,实验中应排除水蒸气、氯气和空气中二氧化碳的干扰,需要除去氯气的洗气装置和对二氧化碳气体干燥的干燥装置;
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.变化过程是在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,阴极上是氢离子得到电子生成氢气.
解答 解:(1)实验的原理是利用CN-+ClO-═CNO+Cl-;2CNO-+2H++3ClO-═N2↑+2CO2↑+3Cl-+H2O,通过测定碱石灰的质量的变化测得二氧化碳的质量,根据关系式计算含氰废水处理百分率,实验中应排除空气中二氧化碳的干扰,防止对装置C实验数据的测定产生干扰,装置D的作用是排除空气中二氧化碳对实验的干扰,
故答案为:防止空气中的CO2和水蒸气进入C装置;
(2)滴有酚酞的氢氧化钡溶液呈红色,二氧化碳通入和氢氧化钡反应生成碳酸钡白色沉淀,氢氧根离子浓度减小,溶液红色会逐渐褪去,
故答案为:有白色沉淀生成,溶液的红色逐渐褪色;
(3)反应后装置中残留二氧化碳,应继续通过将净化的空气,将装置内的残留的二氧化碳全部进入装置C并被Ba(OH)2完全吸收,以减少实验误差,
故答案为:将反应产生的CO2全部排入C装置并被Ba(OH)2完全吸收;
(4)依据反应CN-+ClO-=CNO-+Cl-,2CNO-+2H++3ClO-=N2↑+2CO2↑+3Cl-+H2O,CO2+Ba(OH)2=BaCO3↓+H2O得到,装置C中生成39.4mg沉淀为BaCO3↓物质的量=$\frac{39.4×1{0}^{-3}g}{197g/mol}$=2×10-4mol
CN-+~CNO-~CO2~BaCO3↓
1 1
c(CN-)=$\frac{2×1{0}^{-4}mol}{0.1L}$=0.002mol/L,
故答案为:0.002;
(5)通过直接测量装置C反应前后的质量变化,实验中应排除水蒸气、氯气和空气中二氧化碳的干扰,需要除去氯气的洗气装置和对二氧化碳气体干燥的干燥装置,在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶,
故答案为:在装置B、C之间依次连接盛有CCl4、浓硫酸的洗气瓶;
(6)利用如图2所示装置可以除去废水中的CN-.控制溶液PH为5.2--6.8时,CN-转化为C2O42-和NH4+.变化过程是在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,阴极上是氢离子得到电子生成氢气;
①分析可知气体a是阴极上氢离子得到电子生成的氢气,
故答案为:H2;
②在电解池阳极上CN-失电子发生氧化反应转化为C2O42-和NH4+,电极反应为:2CN-+4H2O-2e-=C2O42-+2NH4+,
故答案为:2CN-+4H2O-2e-=C2O42-+2NH4+.
点评 本题综合考查物质含量的测定的实验设计,以氯气的性质为载体考查化学实验设计和评价问题,题目难度中等,注意把握实验原理和实验方法.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案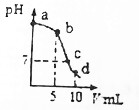 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
| A. | Cu2+、Cl-、Mg2+、NO3- | B. | K+、Cl-、Mg2+、SO42- | ||
| C. | Fe3+、Na+、NO3-、Al3+ | D. | HCO3-、NH4+、Ag+、NO3- |
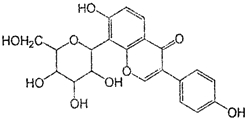
| A. | 该物质在一定条件下能发生消去反应、加成反应、取代反应 | |
| B. | 葛根素的分子式为C21H22O9 | |
| C. | 该物质在一定条件下能与碳酸氢钠溶液反应 | |
| D. | 一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2 |
| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(2)电渗析法淡化海水示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有Mg(OH)2和CaCO3,生成CaCO3的离子方程式是Ca2++OH-+HCO3-=CaCO3↓+H2O.
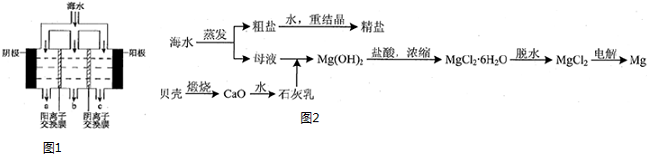
(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图2所示:
在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是bd.
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是溶液变红.
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量盐酸,再加入足量NaOH,将Mg2+转为Mg(OH)2.25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比较,结果偏小.[填“偏大”、“偏小”或“相等”,海水中饱和Mg(OH)2溶液的密度都以lg/cm3计].
| A. | 在常温常压下,2.24LSO2与O2混合气体中所含氧原子数为0.2NA | |
| B. | 50mL12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 标准状况下,20gD20分子中所含中子数为10NA |
 .固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.
.固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑. 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.