题目内容
19. 高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.
高中化学教材介绍了钠、镁、铝、铁、氯、硫、氮、硅等元素及其化合物的知识,是其它化学知识的载体.(1)从以上元素中选择,在自然界中有游离态存在的有N、S、Fe元素(填元素符号).
(2)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后可观察到的现象:右边B(从下列选项中选择)
A.无明显现象 B.溶液由浅绿色变红色
C.溶液由无色变黄色 D.溶液由浅绿色变无色
左边发生反应的离子方程式:2H++2Fe2++H2O2=2H2O+2Fe3+;
若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,
右边充满含3mol Ba(OH)2的溶液,当有2mol SO${\;}_{4}^{2-}$通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为2:3.
(3)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工
艺可进行提纯与综合利用.通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b.(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.)
①若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O.
②若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有Cl-、OH-、AlO2-;然后向滤液中继续加适量乙酸乙酯并加热可得沉淀,写出生成沉淀的离子方程式CH3COOCH2CH3+AlO2-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+CH3COO-+CH3CH2OH.
分析 (1)钠、镁、铝均为活泼金属,氯性质活泼,硅为亲氧元素,Na、Mg、Al、Cl、Si在自然界中全部以化合态存在;
(2)亚铁离子通过阳离子交换膜进入左边被盐酸酸化的H2O2氧化,铁离子通过阳离子交换膜进入右边与KSCN溶液接触,溶液变成血红色,离子方程式为:2H++2Fe2++H2O2=2H2O+2Fe3+;当有2mol SO42-通过交换膜时,根据电荷守恒则有4molOH-进入左室,左室生成氢氧化铝$\frac{4}{3}$mol,右室生成2mol硫酸钡,则左右两室沉淀的物质的量之比为2:3;
(3)根据题意,石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃;
①a应该是SiCl4,结合a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性(Na2SiO3);
②b是AlCl3、FeCl3、MgCl2的混合物,与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有Cl-、OH-、AlO2-;向滤液中继续加适量乙酸乙酯并加热可得沉淀氢氧化铝.
解答 解:(1)Na、Mg、Al、Cl、Si在自然界中全部以化合态存在,N、S、Fe在自然界中有游离态存在,故答案为:N、S、Fe;
(2)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),亚铁离子通过阳离子交换膜进入左边被盐酸酸化的H2O2氧化,铁离子通过阳离子交换膜进入右边与KSCN溶液接触,溶液变成血红色,离子方程式为:2H++2Fe2++H2O2=2H2O+2Fe3+;若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42-通过交换膜时(若反应迅速完全),当有2mol SO42-通过交换膜时,根据电荷守恒则有4molOH-进入左室,左室生成氢氧化铝$\frac{4}{3}$mol,右室生成2mol硫酸钡,则左右两室沉淀的物质的量之比为2:3,
故答案为:B;2H++2Fe2++H2O2=2H2O+2Fe3+;2:3;
(3)根据题意,石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃;
①a应该是SiCl4,结合a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性(Na2SiO3),则反应为SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O,
故答案为:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
②b是AlCl3、FeCl3、MgCl2的混合物,与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有Cl-、OH-、AlO2-;向滤液中继续加适量乙酸乙酯并加热可得沉淀氢氧化铝,生成沉淀的离子方程式为:CH3COOCH2CH3+AlO2-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+CH3COO-+CH3CH2OH,
故答案为:Cl-、OH-、AlO2-;CH3COOCH2CH3+AlO2-+2H2O$\frac{\underline{\;\;△\;\;}}{\;}$Al(OH)3↓+CH3COO-+CH3CH2OH.
点评 本题考查金属及化合物的性质及应用,为高频考点,把握物质的性质、发生的反应、电解原理为解答的关键,注意离子交换膜的作用为解答的难点,侧重分析与应用能力的综合考查,题目难度中等.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案| A. | 探究催化剂对H2O2分解速率的影响:在相同条件下,向一试管中加入2mL5%H2O2和1mLH2O,向另一试管中加入2mL 10%H2O2和1mLFeCl3溶液,观察并比较实验现象 | |
| B. | 提纯含有少量乙酸的乙酸乙酯:向含有少量乙酸的乙酸乙酯中加入过量饱和碳酸钠溶液,振荡后静置分液,并除去有机相的水 | |
| C. | 检验溶液中是否含有Fe3+:取少量待检验溶液,向其中加入少量新制氯水,再滴加KSCN溶液,观察实验现象 | |
| D. | 制备Al(OH)3悬浊液:向1mol•L-1AlCl3溶液中加过量的6mol•L-1NaOH溶液 |
 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中将氨基转化成硝基的反应为氧化反应 |
| A. | 热稳定性H2O>H2S | B. | 还原性Ⅰ->Br->Cl- | ||
| C. | 金属性 K>Na | D. | 酸性 HCl>HF |

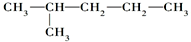 与
与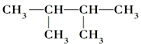
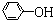 )具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子
)具有弱酸性,其Ka=1.1×10-10;水杨酸第一级电离形成的离子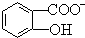 能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是
能形成分子内氢键.据此判断,相同温度下电离平衡常数Ka2(水杨酸)<Ka(苯酚)(填“>”或“<”),其原因是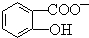 中形成分子内氢键,使其更难电离出H+.
中形成分子内氢键,使其更难电离出H+.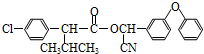 )
)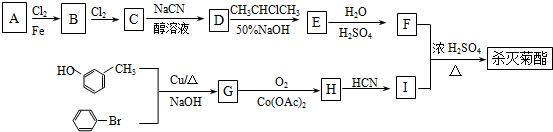
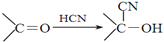
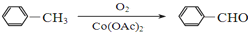
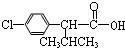 +
+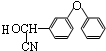 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$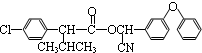 +H2O.
+H2O.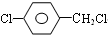 +3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+
+3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+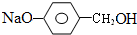 .
. 结构,则符合此条件的F共有8种.
结构,则符合此条件的F共有8种. (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).