题目内容
12.A、B、C、D四种短周期元素,其原子序数依次增大,其中B与C同周期,A与D同主族,C元素的原子最外层电子数是次外层电子数的三倍,又知四种元素所形成的常见单质在常温常压下有三种是气体,一种是固体.请回答下列问题.
(1)固体甲是由元素B、A形成的化合物BA5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电结构,固体甲溶解于水有气体放出.则固体甲属于离子晶体晶体,它的电子式为
 .固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.
.固体甲溶于水后,溶液呈碱(酸、碱或中性),写出甲与水反应的化学方程式NH5+H2O=NH3•H2O+H2↑.(2)由C和D形成的化合物乙溶于水能生成一种气体,写出乙与水反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
分析 A、B、C、D四种短周期元素,其原子序数依次增大,其中B与C同周期,A与D同主族,C元素的原子最外层电子数是次外层电子数的三倍,则C为O元素,又知四种元素所形成的常见单质在常温常压下有三种是气体,一种是固体则A为H元素,B为N元素,D为Na元素,据此解答.
(1)由元素B、A形成的化合物BA5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电结构,可推知A、B均通过电子的转移形成了离子;
(2)和水反应生成气体的钠的含氧化合物有过氧化钠.
解答 解:(1)N、H在化合物BA5中形成了稀有气体原子的最外层电结构,一个H原子得到一个电子形成H-离子,故此化合物为 ,属于离子晶体,
,属于离子晶体, 溶于水反应生成一水合氨使溶液呈碱性,反应方程式为NH5+H2O=NH3•H2O+H2↑,
溶于水反应生成一水合氨使溶液呈碱性,反应方程式为NH5+H2O=NH3•H2O+H2↑,
故答案为:离子晶体;  ;碱; NH5+H2O=NH3•H2O+H2↑;
;碱; NH5+H2O=NH3•H2O+H2↑;
(2)由O和Na形成的化合物Na2O2溶于水能生成一种气体,Na2O2与水反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,综合考查学生分析能力、逻辑推理能力及对知识的迁移运用,需要学生具备扎实的基础.

练习册系列答案
相关题目
20.萜类物质中有许多都已被用于香料工业,常见的有如下图几种结构.下列有关说法正确的是( )
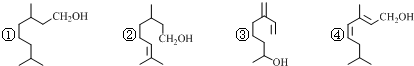
| A. | ①③④互为同分异构体 | |
| B. | ②③④互为同系物 | |
| C. | 上述四种物质中能使酸性KMnO4溶液褪色的只有②③④ | |
| D. | 上述物质分别与足量H2发生加成反应,共可得2种产物 |
17. 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
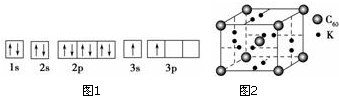
(1)某同学根据上述信息,推断B的核外电子排布如图1所示,该同学所画的电子排布图1(轨道表示式)违背了能量最低原理.
(2)ACl2分子中A原子的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C键的键长大于C60中C-C键的键长,有同学据此认为C60的熔点高于金刚石,你认为是否正确否(填“是”或“否”),并阐述理由C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4S1,该物质的K原子和C60分子的个数比为3:1.
(5)继C60后,科学家又合成了Si60、N60等,C、Si、N元素的电负性由大到小的顺序是N>C>Si,NCl3分子的VSEPR模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为30.
 纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的A和B的单质燃烧时均放出大量热,可用作燃料.已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:| 电离能/(kJ•mol-1) | I1 | I2 | I3 | I4 |
| A | 932 | 1 821 | 15 390 | 21 771 |
| B | 738 | 1 451 | 7 733 | 10 540 |
(2)ACl2分子中A原子的杂化类型为sp杂化.
(3)氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料.已知金刚石中的C-C键的键长大于C60中C-C键的键长,有同学据此认为C60的熔点高于金刚石,你认为是否正确否(填“是”或“否”),并阐述理由C60为分子晶体,熔化时破坏的是分子间作用力,无需破坏共价键.
(4)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图2所示,该物质在低温时是一种超导体.写出基态钾原子的价电子排布式4S1,该物质的K原子和C60分子的个数比为3:1.
(5)继C60后,科学家又合成了Si60、N60等,C、Si、N元素的电负性由大到小的顺序是N>C>Si,NCl3分子的VSEPR模型为正四面体.Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则一个Si60分子中π键的数目为30.
4. 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中将氨基转化成硝基的反应为氧化反应 |
1.(Ⅰ)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注.
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图1:

在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-═H2O+CO2↑.用平衡原理简述CO32-在阴极区再生的过程HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol.
(3)在密闭的再生装置中,加入5mol H2与2mol CO2发生反应生成甲醇,反应达到平衡
时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图2所示,下列说法正确的是A C D
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1>T2>T3>T4
D.T4、P4、时,H2的平衡转化率为60%
(Ⅱ)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
①CH4和NO2反应正反应为放热反应(填“放热”或“吸热”);
②T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
③温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减少(填“增大”、“减小”或“不变”).
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图1:

在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-═H2O+CO2↑.用平衡原理简述CO32-在阴极区再生的过程HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol.
(3)在密闭的再生装置中,加入5mol H2与2mol CO2发生反应生成甲醇,反应达到平衡
时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图2所示,下列说法正确的是A C D
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1>T2>T3>T4
D.T4、P4、时,H2的平衡转化率为60%
(Ⅱ)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
| 时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | 0.5 | 0.5 |
②T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
③温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减少(填“增大”、“减小”或“不变”).
2.(1)已知X、Y、Z为第三周期元素,其原子的第一至第四电离能如下:
则X、Y、Z三种元素中原子半径最小的是Al(填元素符号),三种元素中有两种元素的最高价氧化物对应的水化物能相互反应,写出反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,分子间作用力大因而易液化.
②W分子的VSEPR模型的空间构型为四面体型.
③写出AB-离子的电子式:[:C??N:]-.
(3))E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E、F、G三元素的元素符号分别为K、、Cr、Cu.
②F元素在其化合物中最高化合价为+6.
③G2+离子的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9.G2+和N分子形成的配离子的结构式为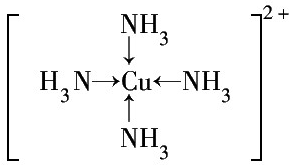 .
.
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
(2)A、B、C、D是周期表中前10号元素,它们的原子半径依次减小.D能分别与A、B、C形成电子总数相等的分子M、N、W,且在M、N、W分子中,A、B、C 三原子都采取SP3杂化.
①N是一种易液化的气体,请简述其易液化的原因氨分子间存在氢键,分子间作用力大因而易液化.
②W分子的VSEPR模型的空间构型为四面体型.
③写出AB-离子的电子式:[:C??N:]-.
(3))E、F、G三元素的原子序数依次增大,三原子的核外的最外层电子排布均为4S1.
①E、F、G三元素的元素符号分别为K、、Cr、Cu.
②F元素在其化合物中最高化合价为+6.
③G2+离子的核外电子排布式为1s22s22p63s23p63d9或[Ar]3d9.G2+和N分子形成的配离子的结构式为
 .
. 
 ;
; .
.