题目内容
16.海水中主要离子的含量如下:| 成分 | 含量/(mg/L) | 成分 | 含量/(mg/L) |
| Cl- | 18980 | Ca2+ | 400 |
| Na+ | 10560 | HCO3- | 142 |
| SO42- | 2560 | Mg2+ | 1272 |
(2)电渗析法淡化海水示意图如图1所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过.阴极上产生氢气,阴极附近还产生少量白色沉淀,其成分有Mg(OH)2和CaCO3,生成CaCO3的离子方程式是Ca2++OH-+HCO3-=CaCO3↓+H2O.

(3)用海水可同时生产氯化钠和金属镁或镁的化合物,其流程如图2所示:
在实验室中由粗盐“重结晶”制精盐的操作包括溶解、过滤、蒸发…洗涤等步骤;有关其中“蒸发”步骤的叙述正确的是bd.
a.蒸发的目的是得到热饱和溶液
b.蒸发的目的是析出晶体
c.应用余热蒸干溶液
d.应蒸发至有较多晶体析出时为止
(4)25℃时,饱和Mg(OH)2溶液的浓度为5×10-4 mol/L.
①饱和Mg(OH)2溶液中滴加酚酞,现象是溶液变红.
②某学习小组测海水中Mg2+含量(mg/L)的方法是:取一定体积的海水,加入足量盐酸,再加入足量NaOH,将Mg2+转为Mg(OH)2.25℃,该方法测得的Mg2+含量与表中1272mg/L的“真值”比较,结果偏小.[填“偏大”、“偏小”或“相等”,海水中饱和Mg(OH)2溶液的密度都以lg/cm3计].
分析 (1)分析海水中存在的离子性质判断,碳酸氢根离子是弱酸阴离子水解显碱性;
(2)阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子,钙离子,氢氧根离子和碳酸氢根离子反应生成生成白色沉淀碳酸钙;
(3)根据氯化钠的溶解度受温度影响不大,所以蒸发的目的是析出晶体,同时蒸发至有较多晶体析出时停止加热;
(4)①根据Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)计算C(OH-),然后判断酸碱性;
②加入盐酸除去HCO3-,防止钙离子干扰;根据5×10-4mol/L的氢氧化镁溶解在水中,所以它就是这个误差值.
解答 解:(1)海水中存在的碳酸氢根离子是弱酸阴离子,水解显碱性,离子方程式为:HCO3-+H2O?H2CO3+OH-,
故答案为:HCO3-+H2O?H2CO3+OH-;
(2)在阴极附近产生少量白色沉淀,阴极是氢离子得到电子发生还原反应,阴极附近氢氧根离子浓度增大,和镁离子生成氢氧化镁沉淀;海水中含有碳酸氢根离子,钙离子,氢氧根离子和碳酸氢根离子反应生成白色沉淀碳酸钙;生成碳酸钙沉淀的离子方程式为:Ca2++OH-+HCO3-=CaCO3↓+H2O,
故答案为:Mg(OH)2;Ca2++OH-+HCO3-=CaCO3↓+H2O;
(3)氯化钠的溶解度受温度影响不大,所以蒸发的目的是析出晶体,同时蒸发至有较多晶体析出时停止加热,
故选:bd;
(4)①饱和Mg(OH)2溶液中Mg(OH)2溶液的浓度为5×10-4mol/L,由Mg(OH)2(s)?Mg2+(aq)+2OH-(aq)可得,C(OH-)=5×10-4mol/L×2=1×10-3mol/L,c(H+)=$\frac{1×1{0}^{-14}}{1×1{0}^{-3}}$mol/L=1×10-11mol/L,溶液呈碱性,滴加酚酞,溶液变红;
故答案为:溶液变红;
②海水中含有HCO3-,钙离子,氢氧根离子和碳酸氢根离子反应生成白色沉淀碳酸钙,影响测定结果,所以加入盐酸除去HCO3-,防止钙离子干扰;溶解的氢氧化镁:5×10-4mol/L×24g/mol=12mg/L,与表中1272mg/L的“真值”比,相对误差约为-$\frac{12}{1272}$×100%=-0.94%,结果偏小.
故答案为:盐酸;偏小.
点评 本题以海水的综合利用为背景,主要考查了海水淡化、电解原理、蒸发结晶、饱和溶液的有关计算,掌握根据化学方程式计算的方法,易错点为(4),题目难度中等.

 苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )
苯佐卡因是局部麻醉药,常用于手术后创伤止痛、溃疡痛等,其结构简式(如图),下列关于苯佐卡因的叙述正确的是( )| A. | 分子式为C9H10NO2 | |
| B. | 苯环上有2个取代基,且含有硝基的苯佐卡因的同分异构体有9种 | |
| C. | 1 mol该化合物最多与4 mol氢气发生加成反应 | |
| D. | 分子中将氨基转化成硝基的反应为氧化反应 |
(1)工业上常用高浓度的K2CO3 溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图1:

在阳极区发生的反应包括4OH--4e-═2H2O+O2↑和H++HCO3-═H2O+CO2↑.用平衡原理简述CO32-在阴极区再生的过程HCO3-存在电离平衡:HCO3-?H++CO32-,阴极H+放电,浓度减小平衡右移.
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇.
已知:25℃,101KPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H1=-242kJ/mol
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2 (g)+2H2O(g)△H2=-676kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50kJ/mol.
(3)在密闭的再生装置中,加入5mol H2与2mol CO2发生反应生成甲醇,反应达到平衡
时,改变温度(T)和压强(P),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如图2所示,下列说法正确的是A C D
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.图示中,该反应的温度变化为:T1>T2>T3>T4
D.T4、P4、时,H2的平衡转化率为60%
(Ⅱ)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
| 时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | 0.5 | 0.5 |
②T1℃时,反应CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)平衡常数K=6.4.
③温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将减少(填“增大”、“减小”或“不变”).
| A. | 热稳定性H2O>H2S | B. | 还原性Ⅰ->Br->Cl- | ||
| C. | 金属性 K>Na | D. | 酸性 HCl>HF |
| A. | 溴苯和水 | B. | 溴乙烷和乙醇 | C. | 甘油和水 | D. | 溴苯和苯 |
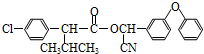 )
)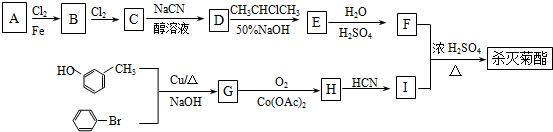
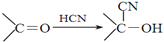
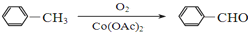
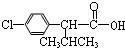 +
+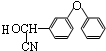 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$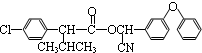 +H2O.
+H2O.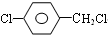 +3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+
+3NaOH$→_{△}^{H_{2}O}$2NaCl+H2O+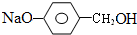 .
.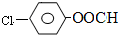 结构,则符合此条件的F共有8种.
结构,则符合此条件的F共有8种.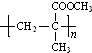 (用合成路线流程图表示,并注明反应条件).
(用合成路线流程图表示,并注明反应条件).