题目内容
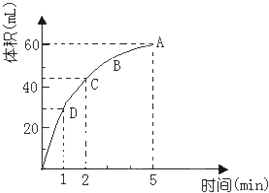 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:(1)放出一半气体所需要的时间为
(2)A、B、C、D各点反应速率快慢的顺序是
(3)在5min后,收集到的气体体积不再增加,原因是
(4)过氧化氢溶液的初始物质的量浓度为
考点:测定某些化学反应的速率
专题:化学反应速率专题
分析:反应方程式为:2H2O2
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积,根据方程式计算过氧化氢浓度.
| ||
解答:
解:(1)由图象可知,当放出一半气体所需要的时间为1min,故答案为:1 min;
(2)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,故答案为:D>C>B>A;
(3)该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,故答案为:此时双氧水已完全分解.
(4)由反应方程式为:2H2O2
2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
由图象可知,生成氧气的体积为60mL,
2H2O2
2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=
=0.00536mol,所以c(H2O2)=
=0.11 mol?L-1,
故答案为:0.11 mol?L-1.
(2)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,故答案为:D>C>B>A;
(3)该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,故答案为:此时双氧水已完全分解.
(4)由反应方程式为:2H2O2
| ||
由图象可知,生成氧气的体积为60mL,
2H2O2
| ||
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=
| 2mol×0.06L |
| 22.4L |
| 0.00536mol |
| 0.05L |
故答案为:0.11 mol?L-1.
点评:本题考查过氧化氢分解的速率曲线,题目难度不大,主要考查浓度对反应速率的影响,注意对图象的分析.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、1molCl2参加的任何反应,反应过程中转移电子数都是2NA | ||
| B、常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | ||
C、标准状况下,1L乙醇完全燃烧产生CO2分子的数目为
| ||
| D、将10mL质量分数为98%的浓H2SO4,用水稀释至100mL,H2SO4的质量分数大于9.8% |
已知:H2O(g)=H2O(l)△H1=-Q1 kJ/mol;
C2H5OH(g)=C2H5OH(l)△H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量是多少kJ( )
C2H5OH(g)=C2H5OH(l)△H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量是多少kJ( )
| A、Q1+Q2+Q3 |
| B、0.5(Q1+Q2+Q3) |
| C、0.5 Q1-1.5 Q2+0.5Q3 |
| D、1.5Q1-0.5Q2+0.5Q3 |

 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如图所示的实验装置.请你根据他们的思路,完成下述的实验报告. 已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题:
已知A为中学化学中的一种深蓝色盐,B、C为日常生活中常见的金属单质,D、G为无色无味气体,各物质之间的转化关系如下图(电解采用惰性电极,部分反应产物已略去).请回答下列问题: