题目内容
已知:H2O(g)=H2O(l)△H1=-Q1 kJ/mol;
C2H5OH(g)=C2H5OH(l)△H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量是多少kJ( )
C2H5OH(g)=C2H5OH(l)△H2=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H3=-Q3 kJ/mol
若使23g酒精液体完全燃烧,最后恢复到室温,则放出的热量是多少kJ( )
| A、Q1+Q2+Q3 |
| B、0.5(Q1+Q2+Q3) |
| C、0.5 Q1-1.5 Q2+0.5Q3 |
| D、1.5Q1-0.5Q2+0.5Q3 |
考点:用盖斯定律进行有关反应热的计算
专题:
分析:23g液态酒精为0.5mol,利用已知的反应得出C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)的反应热,利用物质的量与反应放出的热量成正比来解答.
解答:
解:①H2O(g)═H2O(l)△H1=-Q1kJ?mol-1,
②C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1,
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1,
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-(3Q1-Q2+Q3)kJ/mol,
即1mol液态酒精完全燃烧并恢复至室温,则放出的热量为(3Q1-Q2+Q3)kJ,
则23g液态酒精完全燃烧并恢复至室温,则放出的热量为0.5×(3Q1-Q2+Q3)kJ=1.5Q1-0.5Q2+0.5Q3kJ,
故选D.
②C2H5OH(g)═C2H5OH(l)△H2=-Q2kJ?mol-1,
③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3=-Q3kJ?mol-1,
根据盖斯定律可知,①×3-②+③得C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-(3Q1-Q2+Q3)kJ/mol,
即1mol液态酒精完全燃烧并恢复至室温,则放出的热量为(3Q1-Q2+Q3)kJ,
则23g液态酒精完全燃烧并恢复至室温,则放出的热量为0.5×(3Q1-Q2+Q3)kJ=1.5Q1-0.5Q2+0.5Q3kJ,
故选D.
点评:本题考查学生利用盖斯定律计算反应热,明确已知反应和目标反应的关系是解答本题的关键,题目难度中等.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
下列说法正确的是( )
| A、所有元素中原子半径最小的是F |
B、根据π键的成键特征判断C-C的键能与  键能的关系是双键的键能小于单键的键能的2倍 键能的关系是双键的键能小于单键的键能的2倍 |
| C、元素电负性越小,元素非金属性越强 |
| D、第n周期第n主族的元素均为金属 |
 合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.
合肥市某校化学兴趣小组为探究铁与浓硫酸反应,设计了如图所示装置进行实验.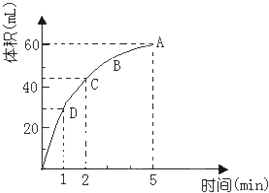 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于50mL密度为1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:
