题目内容
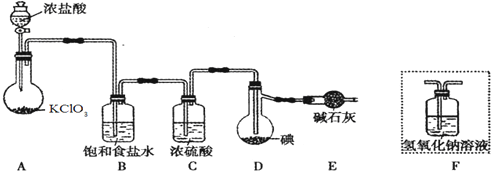
4.研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验: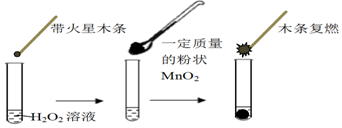
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如表:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl═2FeCl3+2H2O.
分析 (1)H2O2在MnO2催化作用下分解生成水和氧气;
(2)根据表格中数据,二氧化锰质量的增加,相同时间内收集到氧气的体积也相应增加,说明反应速率加快,从而得出结论;
(3)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡的快慢不一样,说明不同催化剂对反应的催化效果不一样,要对比Fe3+和Cu2+对H2O2分解反应的催化效果,必须排除溶液中的阴离子是否有催化作用,试管Ⅲ就很好的解决了这个问题;
(4)根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式.
解答 解:(1)H2O2在MnO2催化作用下分解生成水和氧气,反应的方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,
故答案为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)根据表格中数据,在一定质量范围内,二氧化锰质量的增加,相同时间内收集到氧气的体积也相应增加,说明反应速率加快,原因是在一定质量范围内,固体质量越大,其表面积也越大,故反应速率加快,催化效果更好;
故答案为:在一定质量范围内,MnO2质量越大,反应速率越快;
(3)从所给的数据可知:试管Ⅰ、试管Ⅱ所用试剂的浓度、用量完全一样,产生气泡是试管Ⅰ快,试管Ⅱ慢,试管Ⅲ无气泡产生,试管Ⅲ是一个对比实验,说明Cl-对H2O2的分解没有催化作用,从而得到Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好的结论,
故答案为:Fe3+和Cu2+对H2O2的分解均有催化作用,且Fe3+比Cu2+催化效果好;对比实验,证明Cl-对H2O2的分解没有催化作用;
(4)根据化合价的升降和催化剂会参加反应,但最终性质和质量不改变写出反应方程式,FeCl3和H2O2反应,FeCl3中铁元素化合价降低,生成氯化亚铁,双氧水中氧元素化合价升高,生成氧气,方程式为:2FeCl3+H2O2=2FeCl2+O2↑+2HCl;FeCl3作催化剂,在第二个反应中重新生成,氯化亚铁又被双氧水氧化成氯化铁,方程式为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O;
故答案为:2FeCl2+H2O2+2HCl=2FeCl3+2H2O.
点评 本题考查了催化剂在反应中起到的作用,以及催化剂的质量大小对反应速率的影响探究,并考查了对比实验的重要性,结合催化剂的特点分析催化机理,并对方程式进行推导,综合性较强,题目难度中等.

能表示该反应已达平衡状态的是( )
| A. | 2V正(B)=V逆(D) | |
| B. | 混合气体的密度保持不变 | |
| C. | 混合气体中B、C、D的浓度之比为2:2:1 | |
| D. | 混合气体的压强不随时间变化而变化 |
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z
①S单质 ②C单质 ③NaOH ④NH3.
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
(1)浓盐酸的物质的量浓度为12.5mol.l-1.
(2)配制 240mL 0.1mol•L-1 的盐酸
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
A.用30mL水洗涤烧杯内壁和玻璃棒2〜3次,洗涤液均注入容量瓶,振荡
B.用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1〜2cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤,偏低.
②容量瓶中原有少量蒸馏水,不变.
③定容时观察液面俯视,偏高.
(5)若实验过程中出现如下情况如何处理?
①定容时加蒸馏水时超过了刻度重新配置.
②向容量瓶中转移溶液时有滚液不慎有溶液溅出重新配置.
③定容摇勻后发现液面下降无需再配.
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
(1)工业上可用纯碱、焦炭、氨气在高温下反应可以制取NaCN,写出反应的化学方程式Na2CO3+C+2NH3=2NaCN+3H2O.
(2)工业利用NaCN制备蓝色染料的流程如下:
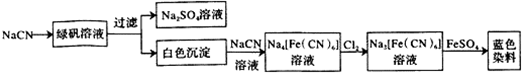
通入Cl2时发生反应的离子方程式为_2[Fe(CN)6]4-+Cl2=2[Fe(CN)6]3-+2Cl-_,该蓝色染料的化学式为Fe3[Fe(CN)6]2.
(3)现代采金技术先以NaCN溶液在自然环境中浸取粉碎的含金(Au)矿石,得到Na[Au(CN)2](二氰合金酸钠)溶液,再用锌还原Na[Au(CN)2]生成金.浸取过程的氧化剂是O2.
(4)上述方法的主要缺点是容易引起水体污染.天津“8.12“爆炸中扩散的CN-也造成了部分水体污染.某小组欲检测污水中CN-的浓度.
资料:碱性条件下发生离子反应:2CN-+5H2O2+2OH-=2CO32-+N2+6H2O
实验装置如图(其中加热、夹持装置省略).(不考虑污水中其它离子反应)
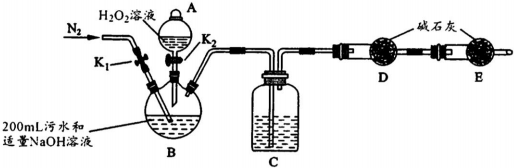
①加入药品之前的操作是检查装置气密性;B的名称是三颈瓶,C中试剂是浓H2S04.
②实验步骤如下:
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热. |
| 步骤2 | 冷却后,用注射器穿过B装置的胶塞注入稀H2S04溶液. |
| 步骤3 | 打开K1,通入N2. |
(5)常温下HCN的电离常数Ka=6.2×10-10,浓度均为0.5mol/L的NaCN和HCN的混合溶液显碱(填“酸”、“碱”或“中”)性,通过计算说明其原因Kh=$\frac{Kw}{Ka}$=$\frac{1{0}^{-14}}{6.2×1{0}^{-10}}$=1.6×10-5>6.2×10-10,即水解平衡常数大于电离平衡常数,所以溶液呈碱性.