题目内容
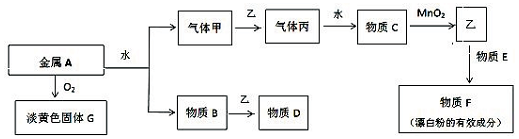
19.已知X、Y、Z、M均为中学常见单质或化合物,它们之间存在如图所示转化关系 (部分产物略去).上述转化中X可能是下列物质中的( )X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z
①S单质 ②C单质 ③NaOH ④NH3.
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 ①若X为单质硫,M为氧气符合转化关系;
②若X为C,M为氧气等符合转化关系;
③若X为NaOH,M为CO2等符合转化关系;
④若X为NH3,M为氧气符合转化关系.
解答 解:①若X为单质硫,M为氧气,二者反应生成Y为SO2,SO2与氧气继续反应得到SO3,符合转化关系,故①符合;
②若X为C.M为氧气,二者反应得到Y为一氧化碳,一氧化碳与氧气反应得到二氧化碳,符合转化关系,故②符合;
③若X为NaOH,M为CO2,二者反应得到碳酸钠,碳酸钠与二氧化碳反应得到碳酸氢钠,符合转化关系,故③符合;
④若X为NH3,M为氧气,二者反应得到NO,NO与氧气反应得到二氧化氮,符合转化关系,故④符合,
故选:D.
点评 本题考查无机物推断,涉及硫、氮、铝、钠等元素化合物性质与转化,熟练掌握元素化合物性质是关键,注意归纳总结中学常见X$\stackrel{M}{→}$Y$\stackrel{M}{→}$Z型转化关系,难度中等.

练习册系列答案
相关题目
14.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 对2HI(g)?H2(g)+I2(g)平衡体系增加压强使颜色变深 | |
| B. | 反应CO(g)+NO2(g)?CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动 | |
| C. | 合成氨反应:N2(g)+3H2(g)?2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施 | |
| D. | 在溴水中存在如下平衡:Br2(g)+H2O(l)?HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅 |
4.研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
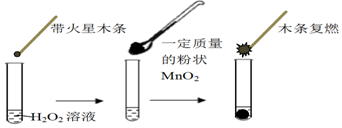
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如表:
由此得出的结论是在一定质量范围内,增加MnO2的质量,化学反应速率加快.
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
结论是Fe3+和Cu2+对H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好,实验Ⅲ的目的是对比实验,说明Cl-对的H2O2分解没有催化效果.
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl═2FeCl3+2H2O.

(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如表:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl═2FeCl3+2H2O.
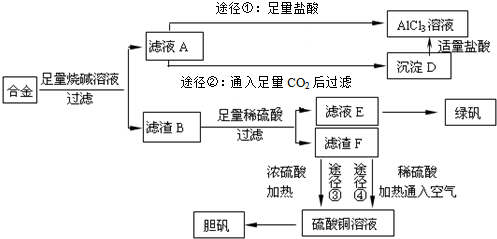
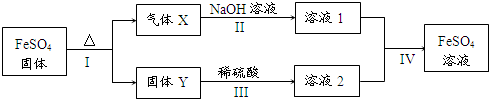
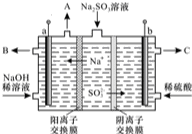 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
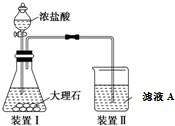
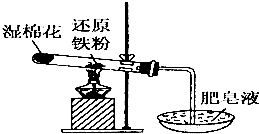 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.