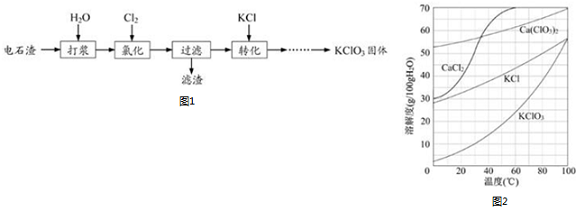
题目内容
12.下列有关化学反应速率的叙述中,正确的是( )| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
分析 A.加入适量的氯化钠溶液,溶液体积增大,反应速率减小;
B.铁片和浓硫酸反应不生成氢气;
C.加入催化剂,平衡不移动;
D.升高温度,反应速率增大,平衡向吸热方向移动.
解答 解:A.加入适量的氯化钠溶液,溶液体积增大,反应物浓度减小,则反应速率减小,故A错误;
B.铁片和浓硫酸在加热时生成二氧化硫,不加热发生钝化,反应不生成氢气,故B错误;
C.加入催化剂,平衡不移动,转化率不变,故C正确;
D.升高温度,活化分子百分数增大,正逆反应速率都增大,故D错误.
故选C.
点评 本题考查化学反应速率的影响因素,为高频考点,侧重于学生的分析能力和基础知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大,注意把握影响化学反应速率的因素与影响原因的关系.

练习册系列答案
相关题目
3.金属钛及钛的合金被认为是21世纪重要的金属材料.常温下钛不和非金属、强酸反应.TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料.
(1)实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;△\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如图:
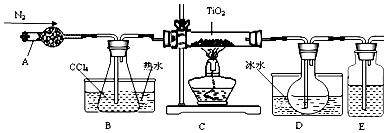
有关物质性质如表:
①仪器A的名称是干燥管,装置E中的试剂是浓硫酸.
②欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(2)工业上可以由钛铁矿(FeTiO3)(含Fe2O3等杂质)制备金属Ti.
工业制备过程由钛铁矿经过酸溶解、过滤以及后续一系列化学变化和物理变化,可以将不溶于水的H2TiO3从溶液中过滤出来,再对H2TiO3进行洗涤,最后对H2TiO3进行煅烧得到TiO2,最终获得金属Ti.过程简化如下:
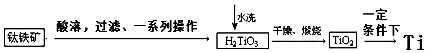
①水洗H2TiO3后,向洗涤液中加滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.
用离子方程式解释“出现微红色”的原因2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3
②以TiO2为原料制取金属钛的其中一步反应为TiO2、氯气和焦炭反应生成TiCl4,己知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为CO.
③用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气(或惰性气氛中);
所得到的金属钛中混有少量杂质,可加入稀盐酸或稀硫酸溶解后除去.
(1)实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;△\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如图:

有关物质性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
②欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(2)工业上可以由钛铁矿(FeTiO3)(含Fe2O3等杂质)制备金属Ti.
工业制备过程由钛铁矿经过酸溶解、过滤以及后续一系列化学变化和物理变化,可以将不溶于水的H2TiO3从溶液中过滤出来,再对H2TiO3进行洗涤,最后对H2TiO3进行煅烧得到TiO2,最终获得金属Ti.过程简化如下:

①水洗H2TiO3后,向洗涤液中加滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.
用离子方程式解释“出现微红色”的原因2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3
②以TiO2为原料制取金属钛的其中一步反应为TiO2、氯气和焦炭反应生成TiCl4,己知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为CO.
③用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气(或惰性气氛中);
所得到的金属钛中混有少量杂质,可加入稀盐酸或稀硫酸溶解后除去.
20.吸毒严重危害身心健康,对肝、肾、脑的损害尤其大,同时易传染疾病,使人变得不负责任,不顾廉耻,一人吸毒祸及全家.下列不属于毒品的是( )
| A. | 麻古(冰毒片剂) | B. | K粉(氯胺酮) | C. | 大麻(四氢大麻酚) | D. | 抗酸药 |
17.下列说法正确的是( )
| A. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| B. | 日常生活中无水乙醇常用于杀菌消毒 | |
| C. | SO2具有漂白性,能使碘的淀粉溶液由蓝色变为无色 | |
| D. | 蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
4.研究催化剂对化学反应有重要意义.为探究催化剂对双氧水分解的催化效果,某研究小组做了如下实验:
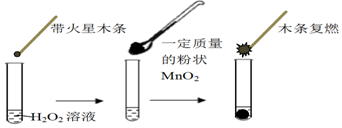
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如表:
由此得出的结论是在一定质量范围内,增加MnO2的质量,化学反应速率加快.
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
结论是Fe3+和Cu2+对H2O2分解均有催化效果,且Fe3+比Cu2+催化效果好,实验Ⅲ的目的是对比实验,说明Cl-对的H2O2分解没有催化效果.
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl═2FeCl3+2H2O.

(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如表:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl═2FeCl3+2H2O.