题目内容
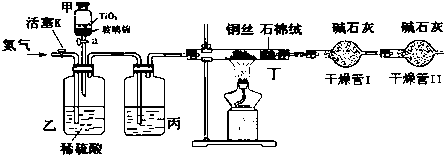
14.已知:ICl的熔点为13.9℃,沸点为97.4℃,易水解,且能发生反应:ICl(l)+Cl2(g)═ICl3(l).(图中夹持装置略去)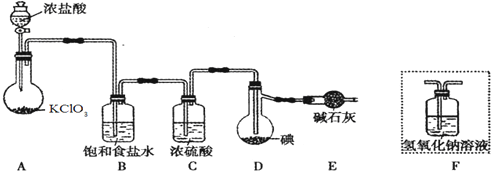
(1)装置A中发生反应的化学方程式是KClO3+6HCl=KCl+3Cl2↑+3H2O.
(2)装置B的作用是除去氯气中的氯化氢.不能用装置F代替装置E,理由 装置F中的水蒸气会进入装置D中,使ICl水解.
(3)所制得的ICl中溶有少量ICl3杂质,提纯的方法是C(填标号).
A.过滤B.蒸发结晶C.蒸馏 D.分液
(4)用ICl的冰醋酸溶液测定某油脂的不饱和度.进行如下两个实验,实验过程中有关反应为:
①
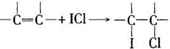
②ICl+KI=I2+KCl
③I2+2Na2S2O3=2NaI+Na2S4O6
实验1:将5.00g该油脂样品溶于四氯化碳后形成100mL溶液,从中取出十分之一,加入20mL某ICl的冰醋酸溶液(过量),充分反应后,加入足量KI溶液,生成的碘单质用a mol/L的Na2S2O3 标准溶液滴定.经平行实验,测得消耗的Na2S2O3溶液的平均体积为V1mL.
实验2(空白实验):不加油脂样品,其它操作步骤、所用试剂及用量与实验1完全相同,测得消耗的Na2S2O3溶液的平均体积为V2mL.
①滴定过程中可用淀粉溶液作指示剂.
②滴定过程中需要不断振荡,否则会导致V1偏小(填“偏大”或“偏小).
③5.00g该油脂样品所消耗的ICl的物质的量为5a(V2-V1)×10-3mol.由此数据经换算即可求得该油脂的不饱和度.
分析 (1)氯酸钾具有氧化性能把浓盐酸氧化生成氯气;
(2)制备的氯气中含有氯化氢,可以用饱和食盐水除去氯气中的氯化氢;装置F中的水蒸气进入装置D中,会使ICl水解;
(3)ICl与ICl3的沸点相差较大;
(4)①碘遇淀粉显蓝色;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应;
③实验2中比实验1多消耗的溶液体积为(V2-V1)ml,其物质的量的是0.001a(V2-V1)mol,
根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,求出ICl的物质的量,
再根据方程式①可知,5.00g该油脂样品所消耗的ICl的物质的量.
解答 解:(1)氯酸钾具有氧化性能把浓盐酸氧化生成氯气,则装置A中发生反应的化学方程式是KClO3+6HCl=KCl+3Cl2↑+3H2O;
故答案为:KClO3+6HCl=KCl+3Cl2↑+3H2O;
(2)浓盐酸易挥发生成的氯气中含有氯化氢,所以装置B中饱和食盐水的作用是除去氯气中的氯化氢,已知ICl易水解,若用装置F代替装置E,则装置F中的水蒸气会进入装置D中,使ICl水解,所以不能用装置F代替装置E;
故答案为:除去氯气中的氯化氢;装置F中的水蒸气会进入装置D中,使ICl水解;
(3)由于ICl与ICl3的沸点相差较大,因此若所制得的ICl中溶有少量ICl3杂质,提纯的方法是蒸馏,故答案为:C;
(4)①由于碘遇淀粉显蓝色,因此滴定过程中可用淀粉溶液作指示剂;故答案为:淀粉溶液;
②滴定过程中需要不断振荡,如果不振荡,则单质碘不能完全反应溶液就会褪色,从而导致消耗硫代硫酸钠的量减小,即会导致V1偏小;
故答案为:偏小;
③实验2中比实验1多消耗的溶液体积为(V2-V1)ml,则Na2S2O3的物质的量的是0.001a(V2-V1)mol,
根据方程式②ICl+KI=I2+KCl和③I2+2Na2S2O3=2NaI+Na2S4O6可知:ICl~2Na2S2O3,
所以ICl的物质的量是0.001a(V2-V1)mol×$\frac{1}{2}$,
由根据方程式①可知,5.00g该油脂样品所消耗的ICl的物质的量为0.001a(V2-V1)mol×$\frac{1}{2}$×$\frac{100ml}{10ml}$=5a(V2-V1)×10-3mol,故答案为:5a(V2-V1)×10-3.
点评 本题考查了物质制备实验方案设计,侧重于实验原理、基本操作、物质性质、数据处理等知识的考查,主要考查了学生的实验操作能力和数据处理能力,题目难度中等.

| 选项 | 项目 | 氨碱法 | 联合制碱法 |
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 可能的副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
| D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
(1)实验室利用反应TiO2(s)+CCl4(g)$\frac{\underline{\;△\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如图:
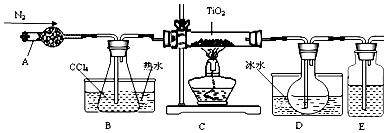
有关物质性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
②欲分离D中的液态混合物,所采用操作的名称是蒸馏.
(2)工业上可以由钛铁矿(FeTiO3)(含Fe2O3等杂质)制备金属Ti.
工业制备过程由钛铁矿经过酸溶解、过滤以及后续一系列化学变化和物理变化,可以将不溶于水的H2TiO3从溶液中过滤出来,再对H2TiO3进行洗涤,最后对H2TiO3进行煅烧得到TiO2,最终获得金属Ti.过程简化如下:
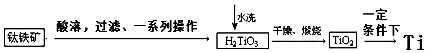
①水洗H2TiO3后,向洗涤液中加滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是Fe2+.
用离子方程式解释“出现微红色”的原因2Fe2++H2O2+2H+=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3
②以TiO2为原料制取金属钛的其中一步反应为TiO2、氯气和焦炭反应生成TiCl4,己知该反应中氧化剂与还原剂的物质的量之比为1:1,则另一生成物为CO.
③用Mg还原TiCl4制金属钛取过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是隔绝空气(或惰性气氛中);
所得到的金属钛中混有少量杂质,可加入稀盐酸或稀硫酸溶解后除去.
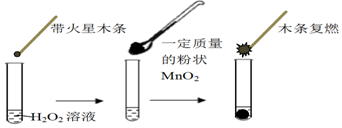
(1)甲同学欲用上图所示实验来证明MnO2是H2O2分解反应的催化剂,写出该反应的化学方程式2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
(2)为探究MnO2的质量对催化效果的影响,乙同学分别量取50mL 1% H2O2加入容器中,在一定质量范围内,加入不同质量的MnO2,测量所得气体体积,数据如表:
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
(3)为分析Fe3+和Cu2+对H2O2分解反应的催化效果,丙同学设计如表实验(三支试管中均盛有10mL 5% H2O2 ):
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
(4)查阅资料得知:将作为催化剂的FeCl3溶液加入H2O2溶液后,溶液中会发生两个氧化还原反应,且两个反应中H2O2均参加了反应,试从催化剂的角度分析,这两个氧化还原反应的化学方程式分别是2FeCl3+H2O2=2FeCl2+O2↑+2HCl和2FeCl2+H2O2+2HCl═2FeCl3+2H2O.
 硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
 .
.